
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。
四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。![]() 元素没有正化合价;
元素没有正化合价;![]() 的氢化物的分子式为
的氢化物的分子式为![]() ,
,![]() 的
的![]() 的单质能从足量酸溶液中置换出
的单质能从足量酸溶液中置换出![]() (标准状况);
(标准状况);![]() 的原子核中没有中子。
的原子核中没有中子。
(1)根据以上条件,推断![]() 、
、![]() 、
、![]() 、
、![]() 的元素名称。
的元素名称。
A________,B ________,C ________,D ________。
(2)用电子式表示![]() 与
与![]() 、
、![]() 与
与![]() 、
、![]() 与
与![]() 相互结合成的化合物,指出其化合物的类型及所含化学键类型。
相互结合成的化合物,指出其化合物的类型及所含化学键类型。
化合物 | 电子式 | 化合物类型 | 化学键类型 |
| _____ | _____ | _____ |
| _____ | _____ | _____ |
B+D | ____ | _____ | _____ |
(3)写出![]() 与
与![]() 所形成的化合物和
所形成的化合物和![]() 与
与![]() 所形成的化合物反应的离子方程式:_______。
所形成的化合物反应的离子方程式:_______。
【答案】氟 氧 钠 氢 ![]() 离子化合物 离子键
离子化合物 离子键 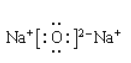 或
或![]() 离子化合物 离子键或离子键和共价键
离子化合物 离子键或离子键和共价键 ![]() 或
或![]() 共价化合物 共价键 Na2O+H2O=2Na++2OH-(或2Na2O2+ 2H2O=4Na++4OH-+O2↑)
共价化合物 共价键 Na2O+H2O=2Na++2OH-(或2Na2O2+ 2H2O=4Na++4OH-+O2↑)
【解析】
![]() 、
、![]() 、
、![]() 的简单离子的结构与氖原子的结构相同,说明
的简单离子的结构与氖原子的结构相同,说明![]() 、
、![]() 、
、![]() 是第二周期的非金属元素或第三周期的金属元素;
是第二周期的非金属元素或第三周期的金属元素;![]() 的氢化物的分子式为
的氢化物的分子式为![]() ,说明
,说明![]() 是氧元素;
是氧元素;![]() 是没有正化合价的元素,说明
是没有正化合价的元素,说明![]() 只能得电子,为氟元素;
只能得电子,为氟元素;![]() 的单质与酸溶液反应能产生
的单质与酸溶液反应能产生![]() ,说明
,说明![]() 为金属元素且在第三周期,再由
为金属元素且在第三周期,再由![]() 的
的![]() 的单质与足量酸溶液反应能产生
的单质与足量酸溶液反应能产生![]() ,说明
,说明![]() 为钠元素;
为钠元素;![]() 的原子核中没有中子,说明
的原子核中没有中子,说明![]() 为氢元素。
为氢元素。
(1)![]() 、
、![]() 、
、![]() 、
、![]() 的元素名称分别为氟 、氧、钠、氢;
的元素名称分别为氟 、氧、钠、氢;
(2)钠和氟形成氟化钠,属于离子化合物,含有离子键,电子式为![]() ;钠和氧形成氧化钠或过氧化钠,都属于离子化合物,氧化钠含有离子键,电子式为:
;钠和氧形成氧化钠或过氧化钠,都属于离子化合物,氧化钠含有离子键,电子式为: 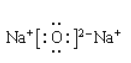 ,过氧化钠中含有离子键和共价键,电子式为:
,过氧化钠中含有离子键和共价键,电子式为: 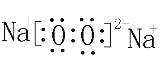 ;氧和氢形成的化合物为水或过氧化氢,属于共价化合物,含有共价键,水的电子式为:
;氧和氢形成的化合物为水或过氧化氢,属于共价化合物,含有共价键,水的电子式为: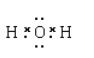 ,过氧化氢的电子式为:
,过氧化氢的电子式为:![]() ;
;
(3)氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,离子方程式为:Na2O+H2O=2Na++2OH-(或2Na2O2+ 2H2O=4Na++4OH-+O2↑)。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:
【题目】某氮肥厂用NH3经一系列反应制得HNO3。NH3→NO→NO2→HNO3。
(1)25℃时,NH3和O2能反应生成NO和液态水,生成6mol水时放热1289kJ,其热化学方程式是_____。
(2)对于反应2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
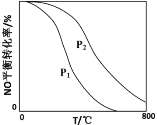
请比较P1、P2的大小:P1____P2(填“>”、“=”或“<”);该反应△H____0(填“>”、“=”或“<”)。
(3)四氧化二氮和二氧化氮可互相转化。在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
①该反应的△H_____0(填“>”、“=”或“<”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为_____molL-1s-1,该温度下反应的平衡常数K=_____。
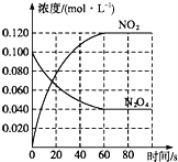
②反应达平衡后,将反应容器的容积缩小到原来的一半,平衡向_____(填“正反应”或“逆反应”)方向移动。
(4)25℃时,将0.1mol·L-1盐酸滴入20mL0.1mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示。
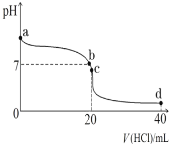
①写出NH3·H2O的电离方程式:_____。
②b点所示溶液中c(Cl-)_____c(NH![]() )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
③c点所示溶液中,离子浓度由大到小的顺序是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中时刻存在着含氮元素不同物质间的转化,实现氮按照一定的方向转化一直是科学领域研究的重要课题。氮气在催化剂作用下的一系列转化如图所示:
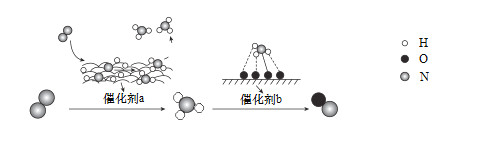
下列叙述正确的是
A.N2转化为NH3、NH3转化为NO均属于氮的固定
B.在催化剂a的作用下,氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.催化剂a、b均可以提高单位时间内反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取4.00g氧化铜和氧化铁固体混合物,加入50.0mL2.00mol·L-1的硫酸充分溶解,往所得溶液中加入5.60g铁粉,充分反应后,得固体的质量为3.04g。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量_________________。
(2)固体混合物中氧化铜的质量_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g) + O2(g)2SO3(g) ΔH ,不同条件下反应过程能量变化如图所示。下列说法中不正确的是

A.反应的 ΔH<0
B.过程b 使用了催化剂
C.过程b 发生两步反应,第一步为吸热反应
D.使用催化剂可以降低反应活化能,提高 SO2 的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | KMnO4 | NaOH | 能制取、收集氯气并能吸收尾气 | |
B | 浓氨水 | 生石灰 | 酚酞稀溶液 | 能制取氨气并验证氨气的水溶液呈碱性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,NCl3是一种黄色黏稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示装置制备NCl3。下列说法正确的是( )

A.每生成1 mol NCl3,理论上有4 mol H+经质子交换膜由右侧向左侧迁移
B.可用湿润的KI-淀粉试纸检验气体M
C.石墨极的电极反应式为NH4++3Cl--6e-===NCl3+4H+
D.电解过程中,电子的流动方向为电源负极→铂棒→石墨棒→电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是( )
A.标准状况下,11.2 L H2O 中含有的氧原子数为0.5NA
B.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
C.16 g O2与16 g O3含有的氧原子数目相等
D.常温常压下,11.2 L氯气所含原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
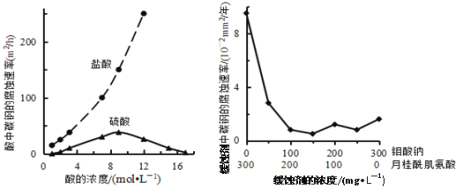
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com