
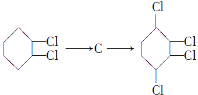
【题目】已知卤代一定条件下可以得到烯烃,现通过以下步骤由![]() 制取
制取![]() ,其合成流程如下:
,其合成流程如下:![]()
![]()
已知:①A的结构简式为![]()
请回答下列问题:
(1)A到B反应类型是________ A中所含官能团的名称为________
(2)B的结构简式为___________________。
(3)A―→B所需的试剂和反应条件为__________。
(4) 这两步反应的化学方程式分别为__________________。
这两步反应的化学方程式分别为__________________。
【答案】消去反应 氯原子 ![]() NaOH的醇溶液,加热
NaOH的醇溶液,加热 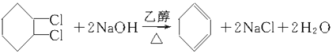 ,
,
【解析】
卤代烃发生消去反应的结构特点:与-X所连碳相邻碳上有氢原子的才能发生消去反应,形成不饱和键;
能发生消去反应生成2种烯烃,说明与氯原子连接的碳原子的相邻的两个碳原子上有氢原子,并且这两个碳原子不是等效的;
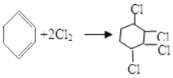
由反应关系可以知道氯苯发生加成反应生成A为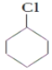 ;
; 发生消去反应生成B为
发生消去反应生成B为![]() ;
;![]() 发生加成反应生成
发生加成反应生成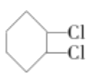 ;
;
 发生消去反应生成C为
发生消去反应生成C为![]() ,
,![]() 发生加成反应可生成
发生加成反应可生成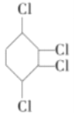 ,以此解答该题。
,以此解答该题。
(1) 发生消去反应生成B为
发生消去反应生成B为![]() ,A到B反应类型是消去反应,A中所含官能团的名称为氯原子
,A到B反应类型是消去反应,A中所含官能团的名称为氯原子
故答案为:消去反应;氯原子;
(2)B的结构简式为![]() 。
。
(3) 发生消去反应生成B为
发生消去反应生成B为 所需的试剂和反应条件为NaOH的醇溶液,
所需的试剂和反应条件为NaOH的醇溶液,
故答案为:NaOH的醇溶液,加热;
(4)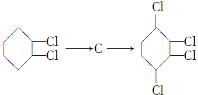 这两步反应的化学方程式分别为:
这两步反应的化学方程式分别为:
 ,
, ;
;
故答案为:
 ,
, 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法可以证明反应N2(g)+3H2(g)![]() 2NH3(g)已达到平衡状态的是( )
2NH3(g)已达到平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H—H键断裂
B.1个N≡N键断裂的同时,有3个H—H键形成
C.3个H—H键断裂的同时,有6个N—H键形成
D.1个N≡N键断裂的同时,有6个N—H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)有相同温度和压强下的两种气体12C18O和14N2,若两种气体的质量相同,则两种气体所含的质子数之比为__________,若两种气体的原子数相等,则两种气体所含中子数之比_________,若两种气体的体积相同,则两种气体的密度之比为_________。
(2)10.8 g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为 ________。
(3)将10 mL1.00 mol/L Na2CO3溶液与10 mL1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为___________(忽略混合前后溶液体积的变化)。
(4)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是_________。
(5)在空气中煅烧CoC2O4生成钴的氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第五周期IIA族元素,其化合物六水氯化锶(SrCl26H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如图:
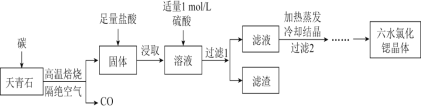
已知:①经盐酸浸取后的溶液中除含有Sr2+和Cl-外,还有少量的Ba2+杂质。
②BaSO4的溶度积常数为2.2×10-10,SrSO4的溶度积常数为3.3×10-7。
③SrCl26H2O的摩尔质量为267g/mol。
(1)工业上天青石焙烧前应先研磨粉碎,其目的是__。
(2)工业上天青石隔绝空气高温焙烧时,若0.5molSrSO4中只有S元素被还原,且转移了4mol电子。则该反应的化学方程式为__。
(3)浸取后加入硫酸的目的是___,用离子方程式表示___。
(4)产品纯度检测:称取2.000g产品溶解于适量水中,向其中加入含AgNO30.01mol的AgNO3溶液。溶液中除Cl-外,不含其它与Ag+反应的离子,待Cl-完全沉淀后,滴入1—2滴含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。已知:SCN-先与Ag+反应。
①滴定反应达到终点的现象是__。
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl26H2O的质量百分含量为___(请列出计算式,无需计算)。
(5)由SrCl26H2O晶体制取无水氯化锶的主要仪器除了酒精灯、泥三角、三脚架外,还有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丁酸跟乙酸具有相似的化学性质,丁醇跟乙醇具有相似的化学性质:CH3CH2CH2CH2OH丁醇 CH3CH2CH2COOH丁酸
试回答下列问题:
(1)分别写出丁醇、丁酸与Na反应的化学方程式:
丁醇+钠:___________________________________;
丁酸+钠:________________________________________。
预计上述化学反应的速率:v(丁醇)________v(丁酸)(填“>”或“<”)。
(2)写出丁酸与丁醇的酯化反应,并注明反应条件________________________________。
(3)写出丁醇在Ag催化下与O2的反应______________________。
(4)判定丁醇能否直接被氧化为丁酸。若能,指出所用氧化剂是什么________(若不能,此空不填);若不能,请说明理由____________________(若能,此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成具有良好生物降解性的有机高分子材料是有机化学研究的重要课题之一。聚醋酸乙烯酯(PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生产安全玻璃夹层材料PVB。有关合成路线如图(部分反应条件和产物略去)。

已知:Ⅰ.RCHO+R’CH2CHO +H2O
+H2O
Ⅱ.![]() (R、R′可表示烃基或氢原子)
(R、R′可表示烃基或氢原子)
Ⅲ.A为饱和一元醇,其氧的质量分数约为34.8%,请回答:
(1)C中官能团的名称为_____,该分子中最多有_____个原子共平面。
(2)D与苯甲醛反应的化学方程式为_____。
(3)③的反应类型是____。
(4)PVAc的结构简式为____。
(5)写出与F具有相同官能团的同分异构体的结构简式____(任写一种)。
(6)参照上述信息,设计合成路线以溴乙烷为原料(其他无机试剂任选)合成 。____。
。____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。

(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com