


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
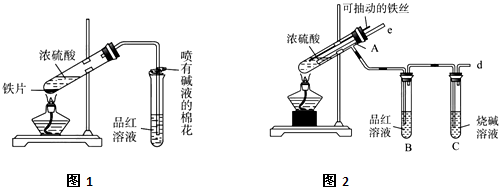
(12分)某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。
(1)比较两实验装置,图2装置的优点是:
①能更好的吸收有毒气体SO2,防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子 的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅲ的可能性,选用如下试剂,填写下列空格:
A.稀HCl溶液 B.稀H2SO4硫酸 C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉KI溶液 G.H2O2溶液
验证Ⅲ:步骤1. 取试样,滴加少量的 (填试剂序号),溶液的颜色变 色, 则试样中含有Fe3+。
步骤2. 再取适量的试样滴加到少量的 (填试剂序号),观察到的现象为 , 则试样中含有Fe2+。
查看答案和解析>>
科目:高中化学 来源:2013届河北省邯郸一中高三9月月考化学化学试卷(带解析) 题型:实验题
(13分)某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。
(1)比较两个实验装置,图2装置的优点是:
①能更好的吸收有毒气体SO2防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到”液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)能说明有SO2气体产生的实验现象是 。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济宁市鱼台二中高一3月月考化学试卷 题型:实验题
(12分)某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。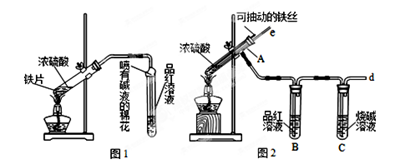
(1)比较两实验装置,图2装置的优点是:
①能更好的吸收有毒气体SO2,防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀H2SO4硫酸 | C.KSCN溶液 | D.KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省名校高三联考(华普2月联考)化学试卷(解析版) 题型:实验题
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如下图所示装置进行实验。
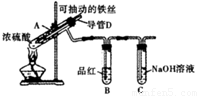
(1)实验过程中,观察到B中的实验现象是 。
一段时间后,观察到从C中有少量的气泡冒出,此气泡的成分是 。
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是 ,反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是 。
(3)反应一段时间后,他们对A中溶液的金属阳离子进行了探究。
①提出假设:
假设1:溶液中只存在Fe2+;
假设2. ;
假设3:溶液中存在Fe2+和Fe3+。
②请你设计实验验证上述假设1,写出实验操作、实验现象及结论。
限选试剂:KMnO4溶液、NaOH溶液、淀粉一KI溶液、KSCN溶液
|
实验操作步骤 |
实验现象 |
结论 |
|
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com