
【题目】下列关于碱金属单质的描述正确的是( )
A. 碱金属都可以保存在煤油中
B. 碱金属与水反应,均浮在水面上
C. 在空气中加热均可生成多种氧化物
D. 硬度小、密度小、熔点低
科目:高中化学 来源: 题型:
【题目】Ⅰ.煤制天然气的工艺流程简图如下:
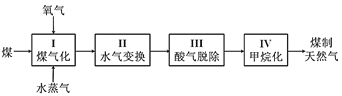
(1)反应Ⅰ:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH =+135 kJ·mol1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
CO(g) + H2(g) ΔH =+135 kJ·mol1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:___________________________。
(2)反应Ⅱ:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH=41 kJ·mol1。如图表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g) + H2(g) ΔH=41 kJ·mol1。如图表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
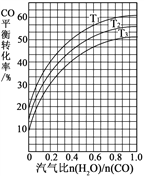
①判断T1、T2和T3的大小关系:______________。(从小到大的顺序)
②若煤气化反应Ⅰ发生后的汽气比为0.8,经煤气化反应Ⅰ和水气变换反应Ⅱ后,得到CO与H2的物质的量之比为1∶3,则反应Ⅱ应选择的温度是_______(填“T1”或“T2”或“T3”)。
(3)①甲烷化反应Ⅳ发生之前需要进行脱酸反应Ⅲ。煤经反应Ⅰ和Ⅱ后的气体中含有两种酸性气体,分别是H2S和_______。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是__________。
Ⅱ.利用甲烷超干重整CO2技术可得到富含CO的气体,将甲烷和二氧化碳转化为可利用的化学品,在能源和环境上的意义重大。该技术中的化学反应为:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0
2H2O(g)+4CO(g) ΔH>0
CH4超干重整CO2的催化转化原理示意如图:
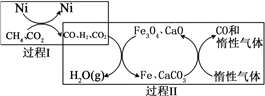
(4)过程Ⅱ,实现了含氢物种与含碳物种的分离。生成H2O(g)的化学方程式是______________。
(5)假设过程Ⅰ和过程Ⅱ中的各步均转化完全,下列说法正确的是_______。((填序号)
a.过程Ⅰ和过程Ⅱ中均含有氧化还原反应
b.过程Ⅱ中使用的催化剂为Fe3O4和CaCO3
c.若过程Ⅰ投料![]() =1,可导致过程Ⅱ中催化剂失效
=1,可导致过程Ⅱ中催化剂失效
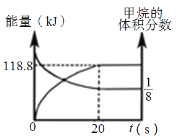
(6)一定条件下,向体积为2 L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的ΔH=________________。
2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,此反应的ΔH=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素原子序数依次喊小,原子半径的大小关系为:r(Y)>r(X)>r(Z), 三种元素的原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )

A. X元素位于ⅥA族 B. A难溶于B中
C. A和C不可能发生氧化还原反应 D. B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如下图所示装置探究化学能与电能的相互转化:
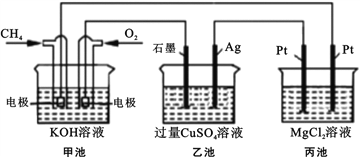
(1) 甲池是_____装置,通入CH4气体的电极上的反应式为_____。乙池中SO42- 移向_____电极(填“石墨”或“Ag”)
(2) 当甲池消耗标况下33.6LO2时,电解质KOH的物质的量变化_____mol,乙池若要恢复电解前的状态则需要加入_____g _____(填物质名称)。
(3) 丙池中发生的电解反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子键、共价键的叙述中正确的是( )
A. 在离子化合物里,只存在离子键,没有共价键
B. 非极性键只存在于双原子的单质分子(如Cl2)中
C. 由多种元素组成的多原子分子里,一定只存在极性键
D. 在共价化合物分子内,一定不存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、Na2SO4 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)判断BaCl2已过量的方法是___________________________________。
(2)第④步中,相关的离子方程式是_______________________________。
(3)为检验精盐纯度,需配230mL0.2mol/L NaCl(精盐)溶液,则需用托盘天平称取精盐固体的质量为_______g。
(4) 配制NaCl(精盐)溶液时需用容量瓶,其在使用前必须______ 。
(5) 配制NaCl(精盐)溶液时,若出现下列操作,其结果偏高的是__________
A.称量时NaCl已潮解 B.天平的砝码已锈蚀
C.定容摇匀后,液面下降又加水 D.定容时俯视刻度线
(6)将已配制好的浓度为C1 mol·L-1NaCl溶液与等质量的水混合后,此时溶液的浓度为C2 mol·L-1 ,则C1 与C2二者的关系为______。
A. C1=2C2 B.C1<2C2 C.C1>2C2 D.2C1<C2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构简式如图所示:下列有关A的性质叙述中,错误的是

A. 与金属钠完全反应时,两者物质的量之比为1:3
B. 与氢氧化钠完全反应时,两者物质的量之比为1:1
C. 与碳酸氢钠溶液反应时,两者物质的量之比为1:2
D. 在一定条件下,既能与羧酸反应,又能与醇反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 第ⅠA 族元素的金属性比第ⅡA 族元素的金属性强
B. 第ⅦA 族元素单质的熔点从上到下逐渐升高
C. 第ⅥA 族元素的氢化物中,稳定性最好的元素非金属性最弱
D. 第三周期元素的离子半径从左到右逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com