
【题目】某温度时,在2 L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
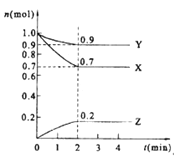
(1)由图中所给数据进行分析,该反应的化学方程式为 ;
(2)反应从开始至2分钟,用Z的浓度变化 表示的平均反应速率为v(Z)= ;
(3)2min反应达平衡容器内混合气体的平均相对分子质量比起始时 (填增大、减小或不变);混合气体密度比起始时 (填增大、减小或不变)。
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X) =" n" (Y) =" n" (Z),则原混合气体中a : b = 。
(5)下列措施能加快反应速率的是 。
A.恒压时充入He
B.恒容时充入He
C.恒容时充入X
D.及时分离出Z
E.升高温度
F.选择高效的催化剂
(6)下列说法正确的是 。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关 D.化学反应的限度是不可能改变的
E. 增大Y的浓度,正反应速率加快,逆反应速率减慢
【答案】(1)3X+Y![]() 2Z (2)0.05mol·L-1·min-1 (3)增大 不变
2Z (2)0.05mol·L-1·min-1 (3)增大 不变
(4)5:3 (5)CEF (6)AC
【解析】试题分析:(1) 由图像可知,X、Y随着时间的推移物质的量不断减少,X、Y为反应物,Z随着时间的推移物质的量不断增加,Z为生成物。平衡时由各物质转化的物质的量:X为0.3 mol,Y为0.1mol,Z为0.2mol可知化学方程式中各物质的化学计量数之比为3∶1∶2,则化学方程式为3X+Y![]() 2Z。
2Z。
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=0.2mol÷(2min×2L)=0.05mol·L-1·min-1 。
(3)根据M=m÷n,在恒容、密闭容器中,混合气体的质量不变,随着反应的进行n值变小,则2min反应达平衡容器内混合气体的平均相对分子质量比起始时增大。由于反应前气体的质量和容器容积均不变,则混合气体密度不变。
(4)根据上述分析可知
3X+Y![]() 2Z
2Z
起始量(mol) a b 0
变化量(mol) 3n n 2n
平衡量(mol) a-3n b-n 2n
根据题意:b-n=2n,b=3n,a-3n=2n,a=5n,解得a:b=5:3。
(5)A.恒压时充入He,导致气体体积增大,各物质的浓度降低,化学反应速率减慢,B.恒容时充入He,各物质的浓度不变,化学反应速率不变,C.恒容时充入X,导致反应物浓度增大,化学反应速率加快,D.及时分离出Z,导致生成物浓度降低,化学反应速率减慢;E.升高温度能加快化学反应速率,F.选择高效的催化剂能加快化学反应速率,答案选CEF。
(6)A.任何化学反应都有热效应,升高温度,平衡发生移动,所以升温能改变化学反应限度,A正确;B.升高温度,能加快正逆反应速率,只是增加的幅度不同,B错误;C.化学反应的限度与时间长短无关,C正确;D.改变外界条件,例如升高温度,平衡发生移动,所以化学反应的限度是可以改变的,D错误;E.增大Y的浓度,正反应速率加快,逆反应速率也加快,E错误;答案选AC。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】海水是巨大的化学资源库,下列有关海水综合利用说法正确的是
A.海水的淡化,必须经过化学变化才能得到
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备金属Na
D.利用海水、铝、空气的航标灯的原理是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中能大量共存的一组离子或分子是
A.NH、H+、NO、HCO
B.Na+、CH3COO-、CO、OH-
C.Na+、K+、SO、Cl2
D.K+、Al3+、SO、NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:
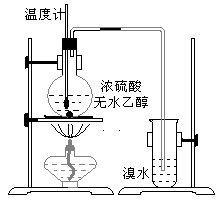
(1)写出甲同学实验中两个反应的化学方程式:____________________________________、____________________________________。
(2)乙同学观察到的黑色物质是__________,刺激性气体是__________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):__________________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。
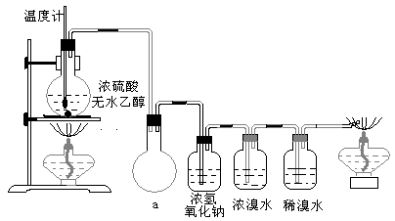
①设计装置a的作用是_____________________________________________
②浓溴水的作用是_________________________________________________,
稀溴水的作用是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为________________________;
(2)A与溴的四氯化碳溶液反应的化学方程式为____________________________。
(3)已知:![]()
![]()
![]() 。 请写出A与稀、冷的KMnO4溶液
。 请写出A与稀、冷的KMnO4溶液
在碱性条件下反应生成物的结构简式__________________________________;
(4)在一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%。写出此化合物的结构简式______________________________;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的作用,下列有关说法不正确的是( )
A.硅酸钠的水溶液俗称水玻璃,可用作木材防火剂
B.“地沟油”经过加工处理后,可以用来制肥皂
C.含磷污水是很好的肥料,可灌溉庄稼,可直接排放到自然界水体中
D.Fe2O3常用于生产红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中物质的分类组合完全正确的是
编号 | A | B | C | D |
强电解质 | Ba(OH)2 | 盐酸 | HClO4 | BaSO4 |
弱电解质 | HI | CaCO3 | HClO | NH3·H2O |
非电解质 | SO2 | NH3 | Cl2 | 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别
B.汽油、乙烯均为石油分馏产品
C.可以用分液的方法分离硝基苯和苯
D.有机化合物都能燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在科研及生产中均有着重要的应用。
(1)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为 。
(2)可逆反应PCl3(g)+Cl2(g)![]() PCl5(g) 2E(g)
PCl5(g) 2E(g)![]() F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
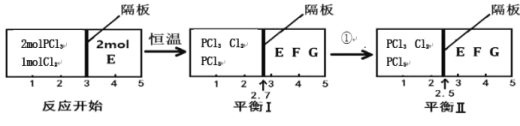
①达到平衡I时,体系压强与反应开始时体系压强之比为 。
②平衡I到平衡II的条件①是 (填“升温”或“降温”)。
(3)亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚磷酸,装置如图所示:

阴极的电极反应式为________________;产品室中反应的离子方程式为 。
(4)一定温度下,Ksp [Mg3(PO4)2] =6.0×10-29,Ksp [Ca3(PO4)2] =6.0×10-26。向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成 沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com