
【题目】碱式碳酸镁[MgCO3·Mg(OH)2·3H2O]是重要的化工原料。用橄榄石制取碱式碳酸镁的一种工艺流程如图所示。

已知:阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L)时的pH如下表所示。
阴离子 | 开始沉淀时的pH | 怡好完全沉淀时的pH |
Fe3+ | 2.7 | 3.7 |
Mg2+ | 9.7 | 11 |
(1)将Mg9FeSi5O20改写成氧化物的形式:___________________。
(2)将橄榄石粉碎的目的是___________________________。
(3)“调节pH”时,应调节的pH范围是________________________。
(4)加入H2O2后发生反应的离子方程式为_____________________________________。
(5)Ksp[Mg(OH)2]=_______。写出生成碱式碳酸镁的离子方程式:_____________________。
【答案】 9MgO·FeO·5SiO2 增大接触面积,提高酸浸速率 3.7≤pH<9.7 2Fe2++2H++H2O2==2Fe3++2H2O 1×10-11 2Mg2++3CO32-+5H2O==MgCO3·Mg(OH)2·3H2O+2HCO3-
【解析】分析:(1)根据硅酸盐的组成元素改写;
(2)粉碎可以增大反应物接触面积;
(3)调节pH的目的是沉淀铁离子,不能沉淀镁离子,据此解答;
(4)双氧水能氧化亚铁离子,据此书写;
(5)根据氢氧化镁完全沉淀时的pH,结合氢氧化镁溶度积常数表达式计算。
详解:(1)Mg9FeSi5O20含有Mg、Fe、Si、O四种元素,根据正负价代数和为0可知铁的化合价是+2价,则改写成氧化物的形式为9MgO·FeO·5SiO2。
(2)将橄榄石粉碎的目的是增大接触面积,加快反应速率,提高酸浸速率。
(3)“调节pH”时需要沉淀铁离子,镁离子不能沉淀,则根据表中数据应调节的pH范围是3.7≤pH<9.7。
(4)双氧水具有氧化性,能把溶液中的亚铁离子氧化,则加入H2O2后发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O。
(5)完全沉淀镁离子时pH=11,则溶液中氢氧根的浓度是0.001mol/L,所以Ksp[Mg(OH)2]=c(Mg2+)·c(OH-)2=10-5×0.0012=1×10-11。根据原子守恒可知生成碱式碳酸镁的同时还有碳酸氢钠生成,则反应离子方程式为2Mg2++3CO32-+5H2O=MgCO3·Mg(OH)2·3H2O+2HCO3-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料,在纺织、造纸、化工合成方面都有重要的用途。
(1)工业上电解饱和食盐水制取氯气:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,理论上每转移1mol电子,生成的氯气在标准状况下的体积为___L。工业上将生成的氯气通入石灰乳制取漂白粉,请写出该反应的化学方程式___________
2NaOH+H2↑+Cl2↑,理论上每转移1mol电子,生成的氯气在标准状况下的体积为___L。工业上将生成的氯气通入石灰乳制取漂白粉,请写出该反应的化学方程式___________
(2)实验室用常用MnO2与浓盐酸共热制氯气,试写出该反应的化学方程式_____________________,若用100mL12mol·L-1的浓盐酸与足量的MnO2反应,则生成的氯气在标准状况下的体积_____6.72L(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2 B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2 D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO![]() +5e﹣+8H+===Mn2++4H2O
+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为______(标准状况),被氧化的HCl的物质的量为____。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g) ![]() H2S(g)+CO(g) △H=+7kJ/mol。
H2S(g)+CO(g) △H=+7kJ/mol。
已知:2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol。
写出表示CO燃烧热的热化学方程式:______________。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率____(填“增大”“减小”或“不变”,下同),COS的转化率_______。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5min内,v(H2S)=_______mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁铝合金(Mg17Al12)有储氢性能,它一定条件下完全吸氢的反应为Mg17Al12+17H2═17MgH2+12Al,得到的混合物Y(17MgH2+12Al)能与酸反应释放出大量氢气.下列说法正确的是
A. 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B. 合金在吸氢过程中被H2还原
C. 一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D. 等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)> V(合金)>V(铝)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有少量NaHCO3杂质,现用如图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:

①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为m1g;
③准确称得m2g纯碱样品放入容器b中;
④打开仪器a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为m3g 。
⑥根据所得数据计算。试回答:
(1)仪器a的名称是___________
(2)装置B中发生反应的离子方程式_____________________________________。
(3)步骤⑤鼓入空气的目的是__________________________________________________。
(4)装置A中试剂X应选用______
A 、NaOH B、浓H2SO4 C、NaHCO3 D、NaCl
(5)如果将a的硫酸换成浓度相同的盐酸,则会导致测定结果______(“偏大”或“偏小”“不变”)
(6)如果除纯碱样品外,没有其他试剂,请设计一个也能测定纯碱样品中Na2CO3的质量分数的实验方案。主要步骤(不需要具体操作)_________________________有关化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
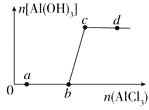
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Ag+、Ca2+、NO3-、F-
C. c点对应的溶液中:Na+、S2-、SO42-、Cl-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com