
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
A.c1:c2=3:1 B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等 D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L
【答案】C
【解析】
试题分析:A.设X转化的浓度为x,
X(g)+3Y(g)![]() 2Z(g)
2Z(g)
初始:c1 c2 c3
转化:x 3x 2x
平衡:0.1moL/L 0.3mol/L 0.08mol/L
则:c1:c2=(x+0.1moL/L):(3x+0.3mol/L)=1:3,故A错误;B.平衡时,正逆反应速率相等,则Y和Z的生成速率之比为3:2,故B错误;C.反应前后X、Y气体的浓度比相同符合反应系数之比,所以达到平衡状态时,转化率相同,故C正确;D.反应为可逆反应,物质不可能完全转化,如反应向正反应分析进行,则0<c1,如反应向逆反应分析进行,则c1<0.14molL-1,故有0<c1<0.14molL-1,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】(1)已知:①2H2(g)+O2(g)=2H2O(l)ΔH1=-571.6kJmol-1
②2CO(g)+O2(g)=2CO2(g)ΔH2=-566.0kJmol-1
③CO(g)+2H2(g)![]() CH3OH(g)ΔH3=-90.8kJmol-1
CH3OH(g)ΔH3=-90.8kJmol-1
计算甲醇蒸气的燃烧热ΔH= 。
(2)对于可逆反应C(S)+H2O(g)![]() CO(g)+H2(g),平衡常数表达式为 ,能判断该反应一定达到化学平衡状态的依据是 。(填选项编号)
CO(g)+H2(g),平衡常数表达式为 ,能判断该反应一定达到化学平衡状态的依据是 。(填选项编号)
A.容器中气体的平均相对分子质量不随时间而变化
B.v正(H2O)=v逆(H2)
C.容器中气体的密度不随时间而变化
D.容器中总质量不随时间而变化
E.消耗n mol H2的同时消耗n mol CO
(3)某化学兴趣小组探究外界条件对合成甲醇反应的影响。
CO(g)+2H2(g)![]() CH3OH(g)△H=-91kJmol-1
CH3OH(g)△H=-91kJmol-1
①在300℃时,向体积为1L的密闭容器中加入2mol H2和1mol CO,CO和CH3OH(g)的浓度随时间变化如图所示。
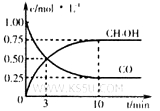
则从反应开始到建立平衡,v(H2)为 ;
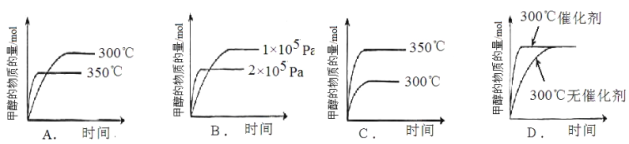
②在其它条件不变时,只改变其中的一个条件,该小组同学根据实验绘制如下图像,其中与事实相符的是 。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下V L氯化氢气体溶解在1L水中(水的密度近似为lg/mL),所得溶液的密度为 ρ g/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.ω= 36.5c/(1000ρ) B.ρ= (36.5V+22400)/(22.4V+22.4)
C.ω = 36.5V/(36.5V +22400) D.c = 1000Vρ/(36.5V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大。A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族。回答下列问题:
(1)A、B、C的第一电离能由大到小的顺序为_______________(用元素符号表示)。
(2)B与C形成的二元化合物中,属于非极性分子的是________(填化学式),该分子中心原子的杂化轨道类型为_____________。
(3)A、C分别形成的常见的含氧酸分子中,中心原子的价层电子对数为4的酸是______(填化学式,下同),酸根呈平面三角形的酸是________________。
(4)Dn+、Br-、C的最高价含氧酸跟、A的简单氢化物按1:1:1:5形成某配合物,向该配合物的溶液中滴加AgNO3溶液产生淡黄色沉淀,滴加BaCl2溶液无现象,则该配合物中的配体为___________,n值为__________,Dn+的基态电子排布式为____________。
(5)立方EB晶体的结构如图所示,其晶胞边长为apm,列式表示EB晶体的密度为__________g·cm-3(不必计算出结果,阿伏伽德罗常数的值为NA)。人工制备的EB晶体中常存在缺陷:一个E2+空缺,另有两个E2+被两个E3+所取代,其结果晶体仍呈电中性,但化合物中E和B的比值却发生了变化。已知某化合物样品组成E0.96B,该晶体中E3+与E2+的离子个数之比为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关。下列过程中没有发生化学变化的是( )
A.氯气作水杀菌消毒剂
B.硅胶作袋装食品的干燥剂
C.二氧化硫作纸浆的漂白剂
D.肥皂水作蚊虫叮咬处的清洗剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子:
(1)I-、Fe2+、NO3-、H+
(2)K+、NH4+、HCO3-、OH-
(3) MnO4-、H+、K+、Cl-
(4)Fe2+、Cu2+、SO42-、Cl-
(5) Na+、K+、Al3+、HCO3-
(6) 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I-
(7)室温下 ![]() 溶液中:Fe2+、NH4+、SO32-、Cl-
溶液中:Fe2+、NH4+、SO32-、Cl-
(8) 0.2 mol/L的NaNO3溶液:H+、Fe2+、SO42-、Cl-
在澄清透明溶液中能大量共存的组别共有
A.1组 B.2组 C.3组 D.不少于4组
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列3种物质:①氯化钠、②氯化钾、③碳酸氢钠的溶液中,呈碱性的是____(填序号,下同);物质组成中含有长周期元素的是____;仅用盐酸即可鉴别出来的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们获得食盐的方式有多种,最主要的是海水晒盐。通过海水晾晒得到的粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,以下是制备精盐的实验流程(试剂以化学式表示)
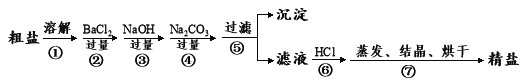
(1)BaCl2、NaOH、Na2CO3的加入顺序,必须保证___________在____________后
(2)溶解、过滤、蒸发过程中都使用到的玻璃仪器是_______ _________,蒸发时玻璃棒的作用是______________________
(3)经过⑤步骤之后得到的沉淀的成分为:________________________
(4)制得的精盐中不小心混入了硝酸钾晶体,用电子天平称取8.00g样品溶于水,向溶液中加入足量硝酸银溶液,将产生的沉淀过滤、洗涤、干燥,并称得其质量为14.35g,则该样品中氯化钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向HC1、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是

A.M点对应的溶液中:K+、Fe2+、NO3-、SO42-
B.N点对应的溶液中:K+、NH4+、HCO3-、Cl﹣
C.S点对应的溶液中:Na+、Ag+、SO42-、NO3-
D.R点对应的溶液中:Na+、SO42-、NO3-、Cl﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com