
| 1000ρω |
| M |
| n |
| V |
| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
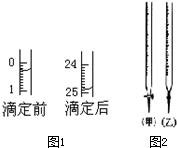 某研究性学习小组的同学用标准浓度的烧碱溶液测定未知浓度的盐酸.
某研究性学习小组的同学用标准浓度的烧碱溶液测定未知浓度的盐酸.查看答案和解析>>
科目:高中化学 来源: 题型:
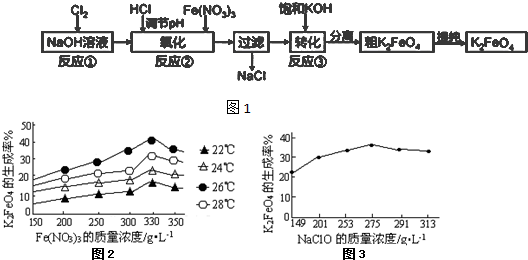
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
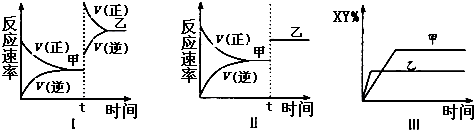
| A、图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2 |
| B、图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低 |
| C、图Ⅱ中,t时间是增大了压强 |
| D、图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com