
【题目】已知0.1mol![]() L-1的二元酸H2A溶液的pH=4.0则下列说法中正确的是
L-1的二元酸H2A溶液的pH=4.0则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中有:2c(Na+)=3c(A2-)+3c(HA-)+3c(HA)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
【答案】B
【解析】
A、在Na2A、NaHA两溶液中,A2-离子水解,HA-存在电离和水解,所以离子种类相同,A错误;
B.根据物料守恒中,在Na2A中存在c(Na+)=2c(A2-)+2c(HA-)+2c(HA),在NaHA中存在c(Na+)=c(A2-)+c(HA-)+c(HA),两种物质的物质的量浓度相等,所以得2c(Na+)=3c(A2-)+3c(HA-)+3c(HA),B正确;
C.根据电荷守恒得c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),C错误;
D.在Na2A溶液中,A2-离子分步水解,溶液呈碱性;一定有:c(Na+)>c(OH-)>c(A2-)>c(H+),D错误;
选B.


科目:高中化学 来源: 题型:
【题目】(1)基态氧原子的价层电子排布式不能表示为2s22px22py2,因为这违背了___________原理或规则。
(2)基态Cu原子核外电子排布式为_______,则高温下的稳定性CuO _____ Cu2O(填“>”或“<”)。
(3)在尿素CO(NH2)2中C、N的杂化方式分别为________,OF2的空间构型是___________。
(4)在Fe(NO3)3溶液中加入Na2SO3,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是_____(用离子方程式表示)。
(5)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,写出氨硼烷的结构式_____,并写出一种与氨硼烷互为等电子体的分子______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
化学式 | 电离常数 |
|
|
|
|
| |
HF |
|
A.在![]() 酸式盐
酸式盐![]() 溶液中一定存在:
溶液中一定存在:![]()
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:![]()
C.已知某温度下常见弱酸的电离平衡常数如上表:相同物质的量浓度的![]() 、NaF、
、NaF、![]() 、
、![]() 水溶液,溶液中离子总数由小到大排列的顺序是
水溶液,溶液中离子总数由小到大排列的顺序是![]()
D.pH均等于3的醋酸与盐酸溶液等体积混合后,溶液的pH基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种物质之间的能量关系如图所示, 下列说法中正确的是
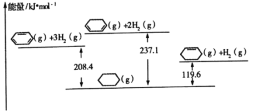
A.使用合适催化剂,能减小反应的焓变
B.![]() +H2(g)
+H2(g)![]()
![]() (g) ΔH=+28.7kJ/mol
(g) ΔH=+28.7kJ/mol
C.![]() (g)中,热能转化为产物内部的能量
(g)中,热能转化为产物内部的能量
D.![]() (g),反应物的总能量低于生成物的总能量
(g),反应物的总能量低于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25mL2mol·L-1的Na2CO3溶液和75mL1mol·L-1的稀盐酸。(1)将Na2CO3溶液逐滴入稀盐酸中;(2)将稀盐酸逐滴滴入Na2CO3溶液中。两操作的现象及结果(标准状况下)为
A.现象相同,所得气体的体积相等B.现象不同,所得气体的体积不等
C.现象不同,所得气体的体积相等D.现象相同,所得气体的体积不等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯为基本原料可制备 X、Y、Z、W 等物质,下列有关说法中正确的是( )
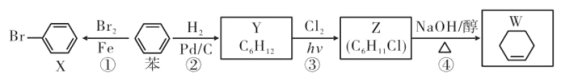
A.反应①是苯与溴水的取代反应
B.反应④中产物除 W 外还有 H2O 和 NaCl
C.X、苯、Y 分子中六个碳原子均共平面
D.可用 AgNO3 溶液检测 W 中是否混有 Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】外观与氯化钠相似的亚硝酸钠(Na2NO2)在生活中应用十分广泛,如可用作建筑钢材缓蚀剂、肉制品发色剂等。已知:2NO+Na2O2=2NaNO2 2NO2+Na2O2=2NaNO3
I.某学习小组设计如图装置制备亚硝酸钠(夹持装置已省略)
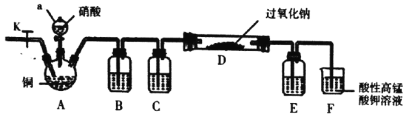
(1)仪器a的名称为________。
(2)装置B、C、E中的试制可选择___。
A 水、浓硫酸、浓硫酸
B 氢氧化钠溶液、浓硫酸、浓硫酸
C 酸性高锰酸钾溶液、浓硫酸、氢氧化钠溶液
D 水、浓硫酸、氢氧化钠溶液
(3)反应开始时先打开止水夹K,通入氮气至F中产生大量气泡,该操作的目的是________。
(4)装置D中的实验现象是________。
(5)装置F中发生反应的离子方程式为________。
Ⅱ.工业上可以用烧碱溶液吸收硝酸厂的尾气制得亚硝酸钠。某学习小组设计如下实验方案测定该产品中亚硝酸钠的质量分数。取1.500g产品配成250mL溶液,取25.00mL溶液于锥形瓶中加入过量的稀硫酸和碘化钾溶液充分反应后,加入适当的指示剂,用0.1000mol/L Na2S2O3标准溶液进行滴定,记录数据如下表。
实验序号 | 1 | 2 | 3 |
Na2S2O3标准溶液体积/mL | 20.02 | 19.98 | 20.00 |
已知: 2NaNO2+2KI+2H2SO4 =2NO↑+I2+2H2O+Na2SO4+K2SO4 2Na2S2O3+I2=Na2S4O6+2NaI
(6)合适的指示剂是________
(7)该产品的纯度为________。
(8)经过讨论,同学认为该产品中可能含有硝酸钠,它会使测定结果________(填“偏高”、“偏低”、“无影响”) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com