
【题目】实验室要用CuSO4·5H2O晶体配制480mL 0.1mol/L CuSO4溶液,回答下列问题:
(1)应该用托盘天平称取CuSO4·5H2O________g。
(2)所需仪器除了烧杯、玻璃棒、胶头滴管,量筒、托盘天平外,还缺少_____________、_________。
(3)实验中两次用到玻璃棒,起作用分别是________________、______________。
(4)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液 ⑦定容
正确的操作顺序是__________________(填序号)。
(5)若实验中有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.胆矾失去了部分结晶水_________________________;
B.定容时加水超过刻度线___________________________;
C.最终定容时仰视观察液面_________________________。
(6)如图是温度计、量筒的一部分,下述读数(虚线对应刻度)及说法正确的是________。

A.①是量筒,读数为2.5 mL B.②是量筒,读数为2.5 mL
C.①是温度计,读数为3.5℃ D.②是温度计,读数为2.5 ℃
【答案】 12.5500mL容量瓶药匙搅拌加速溶解引流⑤①④⑥③⑦②偏高偏低偏低B
【解析】
(1) 配制480mL 0.1mol/L CuSO4溶液,需要用500 mL容量瓶,CuSO4溶质的量等于CuSO4·5H2O晶体的量,则应该用托盘天平称取CuSO4·5H2O质量为:0.1 ×0.5×250= 12.5 g;综上所述,本题答案是:12.5。
(2) 配制溶液的实验中用到的玻璃仪器有量筒、玻璃棒、烧杯、胶头滴管,托盘天平外,还缺少的玻璃仪器有500 mL容量瓶、药匙;综上所述,本题答案是:500mL容量瓶,药匙。
(3)实验中两次用到玻璃棒,第一次是溶解时,搅拌加速溶解;第二次向容量瓶中转移溶液时引流;综上所述,本题答案是:搅拌加速溶解, 引流。
(4) 配制溶液时正确的操作顺序是:⑤称量、①溶解、④冷却、⑥转移溶液、③洗涤、⑦定容(定容前也可以预混匀)、②摇匀;综上所述,本题答案是:⑤①④⑥③⑦②。
(5) A.胆矾失去了部分结晶水,会导致称取的硫酸铜质量偏大,导致溶液中硫酸铜的物质的量偏大,溶液浓度偏高;
B.定容时加水超过刻度线,溶液体积偏大,所配溶液浓度偏低;
C.最终定容时仰视观察液面,溶液体积偏大,所配溶液浓度偏低;
综上所述,本题答案是:偏高,偏低, 偏低。
(6)量筒上没有0刻度值,且数值从下至上逐渐变大,温度计的零刻度线在中间,所以图①是温度计,图②是量筒,
A、图①是温度计,故A错误;
B、量筒精确值为0.1mL,图②中液体体积为2.5mL,故B正确;
C、图①是温度计,读数为2.5℃;故C错误;
D、②是量筒,故D错误;
综上所述,本题选B。


科目:高中化学 来源: 题型:
【题目】以菱锰矿(主要成分![]() 还含有
还含有![]()
![]() 等杂质)为原料制各二氧化锰的工艺流程如下:
等杂质)为原料制各二氧化锰的工艺流程如下:
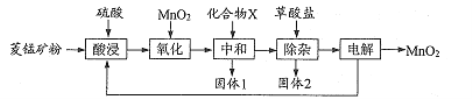
已知草酸钙、草酸镁不溶于水。
(1)写出“氧化”时发生反应的离子方程式:____。
(2)“中和”的目的是将铁、铝元素转化为沉淀除去,化合物X可用 ____(写一种物质的化学式)。
(3)该工艺流程中固体l和固体2均需用水洗涤,目的是________。
(4)“除杂”时,除去的金属离子有___。
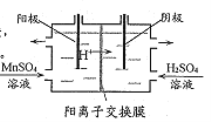
(5)“电解”原理如下图所示,阳极的电极反应式为___
(6)该流程中可以循环使用的物质有 ___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2+能与NH3、H2O、C1-等形成配位数为4的配合物。
(1)[Cu(NH3)4]2+中存在的化学键类型有____(填序号)。
A.配位链 B.极性共价键 C.非极性共价键 D.离子键
(2)[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个C1-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为________________________________。
(3)某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2![]() CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为____________。
CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一些物质之间的转化关系,其中部分反应中反应物或生成物未列全。已知A、I、K均为家庭厨房中的常见物质,其中A是食品调味剂,H是消毒剂的有效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。
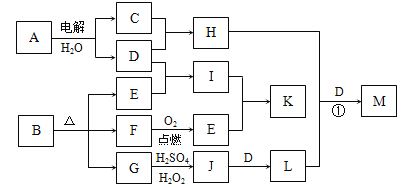
根据以上信息,回答下列问题:
(1)B的组成元素为________________________________。
(2)G→J的离子方程式为_________________________。
(3) M是含氧酸盐,反应①中H、L、D的物质的量之比为3∶2∶4,则M的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)2NO2(g)△H=+57kJmol﹣1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是
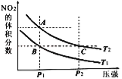
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. A、B两点气体的平均相对分子质量:A>B
D. B、C两点化学平衡常数:B<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如下:
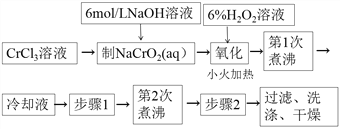
除图中标注的试剂外,实验中还用到6mol·L-1 醋酸,0.5 mol·L-1 Pb(NO3)2溶液,pH 试纸。
已知:①部分物质性质如下
物质 | 性质 | 颜色 | 溶解性 |
Cr(OH)3 | 两性氢氧化物 | 绿色 | 难溶于水 |
Pb(NO3)2 | - | 无色 | 易溶于水 |
Pb(CH3COO)2 | - | 无色 | 易溶于水 |
PbCrO4 | - | 黄色 | 难溶于水 |
Pb(OH)2 | 弱碱性 | 白色 | PH=7.2开始沉淀 ;PH=8.7完全沉淀 |
②PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成
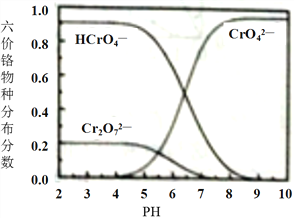
③六价铬在溶液中物种分布分数与pH关系如下图所示。
(1)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是______。
(2)“氧化”时发生反应的离子方程式为______。
(3)下列说法正确的是(______)
A.两次煮沸的目的不相同
B.步骤2可以先加入一滴0.5mol·LPb(NO3)2溶液搅拌片刻,待产生少量沉淀后,继续滴加至有大量沉淀产生。
C.静置后,向上层清液中继续滴入Pb(NO3)2溶液,若无沉淀生成,则说明滴加完全。
D.小火加热的目的是为了避免反应过快。
(4)步骤1为__________________________________________________________。
(5)为测定产品的纯度,可用先用硝酸溶解PbCrO4,然后用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Pb2+ + Y4- =PbY2-。测定时,先称取0.5000g无水PbCrO4产品,溶解后,用0.05000 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水PbCrO4产品的纯度是_________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下(T2> Tl),在3个体积均为2.0 L的恒容密闭容器中反应 2NO(g)+ Cl2(g) = 2ClNO(g)(正反应放热)达到平衡,下列说法正确的是

A. 达到平衡时,容器I与容器II中的总压强之比为1:2
B. 达到平衡时,容器III中ClNO的转化率小于80%
C. 达到平衡时,容器II中c(ClNO(/ c(NO)比容器I中的大
D. 若温度为Tl,起始时向同体积恒容密闭容器中充入0.20 mol NO(g)、0.2 mol Cl2(g)和0.20 mol ClNO(g),则该反应向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为______。
(2)丙池中F电极为____(填“正极”、“负极”、“阴极”或“阳极”),该池总反应的方程式为_____。
(3)当乙池中C极质量减轻4.32g时,甲池中B电极理论上消耗O2的体积为_____mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是______(填字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu(OH)2CO3
(5)甲醇和乙醇都可以做燃料。已知乙醇液体完全燃烧生成CO2气体和1mol液态水时放出热量453.3kJ,请写出乙醇燃烧的热化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按混合物、酸、碱顺序排列的是( )
A.干冰、醋酸、苛性钠
B.氯水、亚硫酸、氢氧化铜
C.蔗糖水、硫酸铜、氢氧化铁
D.水玻璃、硝酸、纯碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com