
【题目】以菱锰矿(主要成分![]() 还含有
还含有![]()
![]() 等杂质)为原料制各二氧化锰的工艺流程如下:
等杂质)为原料制各二氧化锰的工艺流程如下:
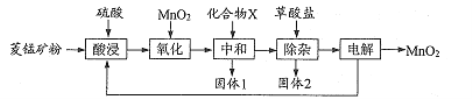
已知草酸钙、草酸镁不溶于水。
(1)写出“氧化”时发生反应的离子方程式:____。
(2)“中和”的目的是将铁、铝元素转化为沉淀除去,化合物X可用 ____(写一种物质的化学式)。
(3)该工艺流程中固体l和固体2均需用水洗涤,目的是________。
(4)“除杂”时,除去的金属离子有___。
(5)“电解”原理如下图所示,阳极的电极反应式为___
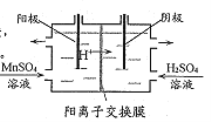
(6)该流程中可以循环使用的物质有 ___ 。
【答案】 MnO2+2Fe2++4H+===Mn2+ +2Fe3++2H2O CaCO3(或MnCO3等合理) 用水洗涤滤渣,洗出液用于酸浸工序,提高锰的回收率(或用水洗涤滤渣,洗出液循环利用,提高锰的回收率等合理) Ca2+、Mg2+ Mn2++2H2O–2e-=== MnO2+4H+ H2SO4、MnO2
【解析】(1)酸浸后溶液中含有亚铁离子,能被二氧化锰氧化,则“氧化”时发生反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O。(2)“中和”的目的是将铁、铝元素转化为沉淀除去,由于不能再引入新杂质,则化合物X可用MnCO3。(3)过滤得到的沉淀表面含有杂质离子,因此该工艺流程中固体l和固体2均需用水洗涤滤渣,洗出液用于酸浸工序,提高锰的回收率。(4)已知草酸钙、草酸镁不溶于水,则“除杂”时,除去的金属离子有Ca2+、Mg2+。(5)阳极锰离子失去电子转化为二氧化锰,则阳极的电极反应式为Mn2++2H2O–2e-=MnO2+4H+。(6)硫酸锰电解生成二氧化锰和硫酸,则该流程中可以循环使用的物质有H2SO4、MnO2。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热B.增加Fe的质量
C.滴加几滴CuSO4溶液D.适当增加稀硫酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于原电池的电极名称,下列叙述有错误的是( )
A.发生氧化反应的为负极B.正极为电子流入的一极
C.比较不活泼的金属为负极D.正极为电解质溶液中阳离子移向的一极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用丁烷催化脱氢侧备丁烯:C4H10(g)![]() CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
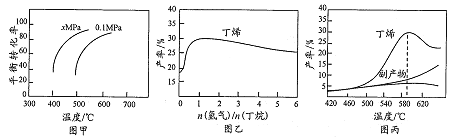
A. 由图甲可知,x小于0.1
B. 由图乙可知,丁烯产率先增大后减小,减小的原因是氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速 率减小
C. 由图丙可知产率在590℃之前随温度升高面增大的原因可能是溫度升高平衡正向移动
D. 由图丙可知,丁烯产率在590℃之后快速降低的主要原因为丁烯高温分解生成副产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
A.升高温度B.加入适量的水C.加入少量CuSO4溶液D.加入浓度较大的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3的摩尔质量为100gmol—1。将5.0gCaCO3固体完全溶于稀盐酸后,再用蒸馏水稀释成100ml溶液。该溶液中Ca2+的物质的量浓度为
A. 5.0 molL—1 B. 0.10 molL—1 C. 1.0 molL—1 D. 0.50 molL—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。

(1)X位于元素周期表中第________周期第________族;W的基态原子核外有_____个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是______(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要用CuSO4·5H2O晶体配制480mL 0.1mol/L CuSO4溶液,回答下列问题:
(1)应该用托盘天平称取CuSO4·5H2O________g。
(2)所需仪器除了烧杯、玻璃棒、胶头滴管,量筒、托盘天平外,还缺少_____________、_________。
(3)实验中两次用到玻璃棒,起作用分别是________________、______________。
(4)配制溶液时有以下几个操作:
①溶解 ②摇匀 ③洗涤 ④冷却 ⑤称量 ⑥转移溶液 ⑦定容
正确的操作顺序是__________________(填序号)。
(5)若实验中有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.胆矾失去了部分结晶水_________________________;
B.定容时加水超过刻度线___________________________;
C.最终定容时仰视观察液面_________________________。
(6)如图是温度计、量筒的一部分,下述读数(虚线对应刻度)及说法正确的是________。

A.①是量筒,读数为2.5 mL B.②是量筒,读数为2.5 mL
C.①是温度计,读数为3.5℃ D.②是温度计,读数为2.5 ℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com