
【题目】下列有关浓硝酸的说法中错误的是( )
A.浓HNO3能溶解金属铜,说明其具有强酸性
B.浓HNO3能与碳反应,说明其具有强氧化性
C.浓HNO3不稳定易分解,需要避光保存
D.常温下浓HNO3能使金属铝钝化,可以用铝槽车运输浓HNO3
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列措施对增大反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,加入少量氯化钠固体
D.将铝片改为铝粉,做铝与氧气反应的实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:

(1)“酸溶”时,Fe2O3与硫酸反应的化学方程式为____。
(2)滤渣I的主要成分是FeS2、S和______(填化学式);Fe3+被FeS2还原的离子方程式为______。
(3)“氧化”中,生成FeOOH的离子方程式为_______________。
(4)滤液II中溶质是Al2(SO4)3和______(填化学式):“洗涤”时,检验铁黄表而已洗涤干净的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:

(1)保存过氧化氢的试剂瓶上最适合贴的标签是_____________(填字母)。
(2)下列反应中,H2O2体现还原性的是______________。
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
D.K2Cr2O7+4H2O2+2H+ =2CrO5+5H2O[CrO5称为过氧化铬,可写成CrO(O2)2]
(3)采矿废液中的氰化物(如KCN)一般用H2O2做无毒化处理,化学方程式为:KCN+H2O2+H2O=KHCO3+NH3↑(KCN中N为﹣3价),生成1mol NH3时转移的电子数为___________。
(4)H2O2被称为绿色氧化剂的理由是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 标准状况下,22.4 L 14CO2与44 g 14CO2含分子数均为NA
B. 1 mol CH3COOH与足量CH3CH2OH在浓硫酸存在下共热生成NA个乙酸乙酯分子
C. 常温下,pH=13的NaOH溶液中含OH-离子数为0.1 NA
D. 浓度为2 mol/L的FeCl3溶液500 mL水解后生成Fe(OH)3胶体粒子数目小于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
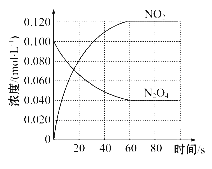
回答下列问题:
(1)反应的ΔH____0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为____mol·L-1·s-1;反应的平衡常数K1为________。
(2)100℃时达平衡后,改变反应温度为T,经10 s又达到平衡,且c (N2O4)为0.01 mol·L-1。
① T___100℃(填“大于”或“小于”),判断理由是_______________。
② 计算温度T时反应的平衡常数K2 ______。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______(填“正反应”或“逆反应”)方向移动,判断理由是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com