
【题目】在一定温度下,将气体X和Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v逆>v正
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
【答案】C
【解析】
试题分析:A.2min内Y物质的量变化为0.16mol-0.12mol=0.04mol,v(Y)=0.04mol÷(10L×2min)=0.002mol/(Lmin),速率之比等于化学计量数之比,v(Z)=2v(Y)=2×0.002mol/(Lmin)=0.004mol/(Lmin),A项错误;B.该反应正反应是放热反应,降低温度平衡向正反应移动,反应达到新平衡前v(逆)<v(正),B项错误;C.由表中数据可知7min时,反应到达平衡,平衡时Y的物质的量为0.10mol,则:
X(g)+Y(g)2Z(g)
开始(mol):0.16 0.16 0
变化(mol):0.06 0.06 0.12
平衡(mol):0.1 0.1 0.12
由于反应气体氢气的化学计量数相等,用物质的量代替浓度进行计算,化学平衡常数k=(0.12×0.12)÷(0.1×0.1)=1.44,C项正确;D.再通入0.2 mol Z,等效为在原平衡基础上增大压强,反应前后气体的体积不变,平衡不移动,X的体积分数不变,D项错误;答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,正确的是( )
A.乙醇可以氧化为乙醛或乙酸,三者都能发生酯化反应
B.苯酚钠溶液中通入CO2生成苯酚,表明苯酚的酸性比碳酸的强
C.乙酸乙酯在酸性或碱性条件下都能发生水解反应
D.可用FeCl3溶液来区分 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
①两烧杯中铜片表面均无气泡产生
②甲中铜片是正极,乙中铜片是负极
③两烧杯中溶液的c(H+)均减小
④产生气泡的速率甲比乙慢
⑤甲中SO![]() 向Zn片移动,H+向Cu片移动
向Zn片移动,H+向Cu片移动
⑥乙中电流从Cu片流向Zn片
⑦甲、乙两烧杯中Cu片的质量均不变.

A.①②③ B.③⑤⑦ C.④⑤⑥ D.②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想.运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物.已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键.
(1)该氮氢化合物的电子式为 .
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式 .
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl.试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①178O、②188O、③2311Na、④2412Mg、⑤146C、⑥147N中:
(1) 和 互为同位素(填序号,下同);
(2) 和 的质量数相等,但不能互称同位素;
(3) 和 的中子数相等,但质子数不等,所以不是同一种元素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,在① ~⑩元素中,试用元素符号或化学式等化学用语回答下列问题:

(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是,碱性最强的是
(3)用电子式表示②与④形成化合物的过程
(4)单质⑤与③的最高价氧化物对应的水化物反应的离子方程式是
(5)①和⑥形成的化合物是一种新型的高温结构陶瓷,该化合物中含有的化学键类型是
(6)②③和⑦元素的原子半径由大到小的顺序是__________,它们形成的简单离子中,离子半径由大到小的顺序是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六组物质:属于同系物的是 ,属于同分异构体是 ,属于同种物质的是 .(填序号)
A.![]() 与
与![]()
B.![]() 与
与![]()
C.![]() 与
与![]()
D.![]() 与
与![]()
E.ClC(CH3)3与(CH3)2CHCH2Cl
F.![]() 与CH3﹣CH2Cl.
与CH3﹣CH2Cl.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如下图所示,电池总反应为2Ag+Cl2==="2AgCl" 。下列说法正确的是
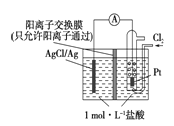
A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH![]() 的物质的量为b mol,下列叙述中一定正确的是
的物质的量为b mol,下列叙述中一定正确的是
A.溶质的质量分数为ω=![]() ×100%
×100%
B.溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C.溶液中c(OH-)=![]() mol· L-1
mol· L-1
D.上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5ω
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com