
����Ŀ��±��Ԫ���Ƿǽ����Ժ�ǿ��һ��Ԫ�أ����γɶ������ʡ�
(1)���������������ֻ�ԭ��,ͬʱ���ʵ��������ֿɷ�������������ԭ��Ӧ��
�ٽ�����������ͨ�뵽H2S��Һ�У��������õ���Һ�м����������ữ��BaCl2��Һ�ɵõ���ɫ����,д��ǰһ����Ӧ�����ӷ���ʽ��____________________________��
�ڽ�0.1molCl2����ͨ�뵽amL��Ũ��Ϊ2mol/L��KOH��Һ�У�����ǡ�÷�Ӧ��,�����Һc(ClO-)��c(ClO3-)��c(Cl-)=2��1��7,��a=______________��
(2)KClO3��һ����Ҫ��������,��ҵ���Ʊ�KClO3�ķ���֮һ���£�
![]()
��д�����ʱ��Ӧ�Ļ�ѧ����ʽ��_______________________________��
����ͬ�¶���,���������ε��ܽ����Դ�С��NaClO3___________KClO3(�>����<��)��
��KClO3��MnO2�Ĵ������¼��ȷֽ����������ķ�Ӧ�������£�����д�հ״���
2KClO3+2MnO2![]() 2KMnO4+Cl2��+O2��;
2KMnO4+Cl2��+O2��;
2KMnO4![]() K2MnO4+MnO2+O2����
K2MnO4+MnO2+O2����
K2MnO4+Cl2![]() O2��+___________+___________��
O2��+___________+___________��
��Ӧ��������������뿪����Ҫ������__________________________��
(3)��֪Cl2O������������,��Cl2Oͨ�뵽ˮ�пɵõ�һ��������Һ����д������Һ���еij��������һ�ֻ�ѧ����______________������������ͨ�뵽NaOH��Һ��ǡ����ȫ��Ӧ,����Һ�и�����Ũ���ɴ�С��˳��Ϊ______________________��
���𰸡�4Cl2+H2S+4H2O=10H++SO42-+8Cl-100NaCl+3H2O![]() NaClO3+3H2>2KClMnO2�ܽ⡢���ˡ�ϴ�ӡ������ᾧƯ���Ի�ǿ�����Ե�c(Na+)>c(ClO-)>c(OH-)>c(H+)
NaClO3+3H2>2KClMnO2�ܽ⡢���ˡ�ϴ�ӡ������ᾧƯ���Ի�ǿ�����Ե�c(Na+)>c(ClO-)>c(OH-)>c(H+)
��������
(1)���������õ���Һ�м����������ữ��BaCl2��Һ�ɵõ���ɫ����������Һ����SO42-���ɣ��ʴ�Ϊ��4Cl2+H2S+4H2O=10H++SO42-+8Cl-�����ɷ�Ӧ��������Ԫ�ظ���Ԫ�ص������غ�ɵù�ϵʽ��Cl2~2KOH������a��10-3L��2mol/L=0.1mol��2��a=100���ʴ�Ϊ100��
(2)����Ϊ��������û�и�Ĥ���ʵ���������������NaOH��Ӧ����NaClO3���ʴ�ΪNaCl+3H2O![]() NaClO3+3H2��������NaClO3����KCl��������KClO3���壬�ɸ��ֽⷴӦ���ɿ�֪KClO3���ܽ�ȸ�С���ʴ�Ϊ��>����KClO3��MnO2�Ĵ������¼��ȷֽ������������ܷ�ӦΪ��2KClO3
NaClO3+3H2��������NaClO3����KCl��������KClO3���壬�ɸ��ֽⷴӦ���ɿ�֪KClO3���ܽ�ȸ�С���ʴ�Ϊ��>����KClO3��MnO2�Ĵ������¼��ȷֽ������������ܷ�ӦΪ��2KClO3![]() 2KCl+3O2������Ϸ�Ӧ���̿�֪��ӦK2MnO4+Cl2
2KCl+3O2������Ϸ�Ӧ���̿�֪��ӦK2MnO4+Cl2![]() O2��+2 KCl+MnO2����Ӧ�������������Ҫ��KCl��MnO2��MnO2Ϊ������ˮ�Ĺ��壬������ӵIJ���Ϊ���ܽ⡢���ˡ�ϴ�ӡ������ᾧ���ʴ�Ϊ��2KCl��MnO2���ܽ⡢���ˡ�ϴ�ӡ������ᾧ��(3) Cl2O������������Ǵ���������������뷴Ӧ���ɵĴ��������ǿ�����ԣ���NaOH��Һ��ǡ����ȫ��Ӧ�����ɵ���NaClO����������ǿ���Σ���Һ�ʼ��ԣ�����Һ������Ũ�ȵĴ�С��ϵΪ��c(Na+)>c(ClO-)>c(OH-)>c(H+)���ʴ�Ϊ: Ư���Ի�ǿ�����Եȡ�c(Na+)>c(ClO-)>c(OH-)>c(H+)��
O2��+2 KCl+MnO2����Ӧ�������������Ҫ��KCl��MnO2��MnO2Ϊ������ˮ�Ĺ��壬������ӵIJ���Ϊ���ܽ⡢���ˡ�ϴ�ӡ������ᾧ���ʴ�Ϊ��2KCl��MnO2���ܽ⡢���ˡ�ϴ�ӡ������ᾧ��(3) Cl2O������������Ǵ���������������뷴Ӧ���ɵĴ��������ǿ�����ԣ���NaOH��Һ��ǡ����ȫ��Ӧ�����ɵ���NaClO����������ǿ���Σ���Һ�ʼ��ԣ�����Һ������Ũ�ȵĴ�С��ϵΪ��c(Na+)>c(ClO-)>c(OH-)>c(H+)���ʴ�Ϊ: Ư���Ի�ǿ�����Եȡ�c(Na+)>c(ClO-)>c(OH-)>c(H+)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӏ�������ֵ������˵����ȷ����( )
A. 1molNa2O2�����к���������Ϊ4 NA
B. ������ΪNA��CO��C2H4����������ԼΪ22.4L������Ϊ28g
C. 28g��C2H4��C3H6��ɵĻ�����к�����ԭ�ӵ���ĿΪ4NA
D. �����£�1mol Fe�����ŨHNO3��Ӧ��ת�Ƶ��ӵ���ĿΪ3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��R��Q��M�����ֶ�����Ԫ�أ�ԭ��������������X��ԭ�Ӱ뾶��С��Ԫ�أ�Y����̬�⻯����ʹʪ��ĺ�ɫʯ����ֽ������ZΪ�ؿ��к�������Ԫ�أ�R��Xͬ���壻Y��R��Q����������֮��Ϊ8��M�ĵ���Ϊ����ɫ�к����塣��ش��������⣺
��1��R��Ԫ�����ڱ��е�λ��Ϊ__________________��
��2��Z��Q��M�����Ӱ뾶�ɴ�С��˳��Ϊ(дԪ�����ӷ���)_______________��
��3��X��Y��Z����Ԫ���γ���������ˮ��Һ�����Ե�ԭ��________________(�����ӷ���ʽ��ʾ)����Һ����������Ũ���ɴ�С��˳��Ϊ______________��
��4��YX4M�ĵ���ʽΪ______________��Q3Y2��ˮ�ɾ��ҷ�Ӧ���������������壬��Ӧ�Ļ�ѧ����ʽΪ_________________________________��
��5��M�ĵ�����R������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��KClO3��Ũ������һ���¶��·�Ӧ����ԭ����Ϊ����ɫ���ױ���������ȡ���仯���Ա�ʾΪ����KClO3+��HCl��Ũ������KCl+��ClO2��+��Cl2��+��H2O+��__________
(1)����ƽ�û�ѧ����ʽ_____________________________________��
(2)Ũ�����ڷ�Ӧ����ʾ������������______________________________(����)��
��ֻ�л�ԭ�Ԣڻ�ԭ�Ժ����Ԣ�ֻ�������Ԣ������Ժ�����
����֪��Ӧ��2H2CrO4+3H2O2=2Cr(OH)3��+2H2O�÷�Ӧ��H2O2ֻ�������±仯����H2O2��H2O
(1)�÷�Ӧ�еĻ�ԭ����__________________________��
(2)�÷�Ӧ�б���ԭ��Ԫ����_______________����ԭ������_____________________��
(3)�������������ڱ�״�������Ϊ3.36L����Ӧ��ת����_________mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֽ�13.92g��MnO2��150g 36.5�����ᣨ�������������ȣ���Ӧ�����Һ������������������Һ��������ɫ������������HCl�Ļӷ�������˵����ȷ����
A. ����AgCl����Ϊ0.86mol B. ת�Ƶ�����0.64NA
C. ��������HClΪ0.32mol D. ����Cl2 3.584L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��Ϊ̽�������Թ���X����ɺ����ʣ�����������ʵ�顣��֪X��һ�ֽ���������Ԫ�صľ��й̶��ɵ��������ʣ�H�ɵ�Ԫ�غ�����һ��Ԫ����ɣ�ͼ����������������ڱ�״���²ⶨ��
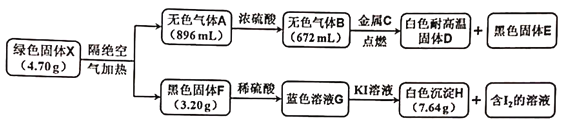
��ش��������⣺
��1��д��X�Ļ�ѧʽ__________��
��2��д��C��ԭ�ӽṹʾ��ͼ___________�����EԪ�ص�ij�ֺ��س����ڿ��Ŷϴ�����ԭ�Ӻ���������Ϊ8��д����У�ص�ԭ�ӷ���___________��
��3��C��װ��B�ļ���ƿ��ȼ�գ���ʵ������Ϊ___________����д����Ӧ�Ļ�ѧ����ʽ___________��
��4����֪H���뺬NaClO�ļ�����Һ��Ӧ����NaIO3����ɫ��״��������д���÷�Ӧ�����ӷ���ʽ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡһ������NaHCO3��Na2O�Ĺ�����������������ˮ����������Һ�ֳ����ȷݣ�������һ��ˮ��Һ�л�����μ���ij���ʵ���Ũ�ȵ����ᣬ��������������������������֮��Ĺ�ϵ��ͼ��ʾ������һ��ˮ��Һ�м������Ba(OH)2��Һ���õ���ɫ����39.4g���Իش��������⣺

��1����������ʵ���Ũ��Ϊ___________��
��2������������NaHCO3��Na2O���ʵ���֮��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ҹ��������������������2.5�����µ�ϸ������(PM2.5)�ǵ�������������������������������е�CO��SO2�������������Ⱦ�����ͨ��������ѧ��Ӧ����PM2.5�����
��1�� ��CaSO4����O2��ȼ��CO��Ӧ����һ�ָ�Ч����ࡢ���õ�����ȼ�ռ������ȿ����ȼ��Ч�ʣ����ܵõ��ϴ���CO2���Ա��ڱ���������Ӧ��Ϊ����Ӧ����Ӧ�ں͢�Ϊ����Ӧ��
����CaSO4(s)��4CO(g)==CaS(s)��4CO2(g) ��H1����189.2 kJ��mol-1
����CaSO4(s)��CO(g)==CaO(s)��CO2(g)��SO2(g)�� ��H2����210.5 kJ��mol-1
����CO(g)==![]() C(s)��
C(s)��![]() CO2(g) ��H3����86.2 kJ��mol-1
CO2(g) ��H3����86.2 kJ��mol-1
��Ӧ2CaSO4(s)��7CO(g)==CaS(s)��CaO(s)��6CO2(g)��C(s)��SO2(g)����H��_________________
��2����֪��CO����CO2�Ļ�ѧ����ʽΪCO��O2![]() CO2��O��������Ӧ����Ϊv��=K����c(CO) ��c(O2)���淴Ӧ����Ϊv��=K����c(CO2) ��c(O)��K����K��Ϊ���ʳ�������2500 K����K��=1.21��105 L��s-1��mol-1��K��=3.02��105 L��s-1��mol-1������¶���������Ӧ��ƽ�ⳣ��KֵΪ________(����С�����һλС��)��
CO2��O��������Ӧ����Ϊv��=K����c(CO) ��c(O2)���淴Ӧ����Ϊv��=K����c(CO2) ��c(O)��K����K��Ϊ���ʳ�������2500 K����K��=1.21��105 L��s-1��mol-1��K��=3.02��105 L��s-1��mol-1������¶���������Ӧ��ƽ�ⳣ��KֵΪ________(����С�����һλС��)��
��3���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������Ӧ��C(s)��2NO(g)![]() N2(g)��CO2(g)����H=Q kJ��mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)��CO2(g)����H=Q kJ��mol-1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
ʱ��(min) Ũ��(mol��L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
��0��10 min�ڣ�NO��ƽ����Ӧ����v(NO)=___________________________________��
��30 min��ֻ�ı�ijһ��������Ӧ����ƽ�⣬�����ϱ������жϸı������������____(ѡ����ĸ)��
a������һ�����Ļ���̿ b��ͨ��һ������NO c���ʵ���С��������� d��������ʵĴ���
����30min�������¶���T2�����ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ5��3��3����Q_____0 (������������������������)��
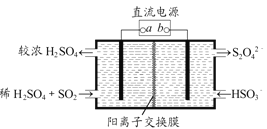
��4��������ͼ��ʾ���װ��(�缫��Ϊ���Ե缫)Ҳ������SO2�������������ų�����Һ����NO2�����Դb�����ӵĵ缫�ĵ缫��ӦʽΪ____________________________________��
��5��NO2��һ�������¿�ת��ΪNH4NO3��NH4NO2����ͬ�¶�������Ũ��NH4NO3��NH4NO2������Һ�����NH4NO2��Һ��c(NH4+)��С���������ܵ�ԭ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��700��ʱ��H2��g����CO2��g��![]() H2O��g����CO��g�������¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v (H2O)Ϊ0.025 mol/��L��min���������жϲ���ȷ���ǣ� ��
H2O��g����CO��g�������¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v (H2O)Ϊ0.025 mol/��L��min���������жϲ���ȷ���ǣ� ��
��ʼŨ�� | �� | �� | �� |
C��H2��/mol/L | 0.1 | 0.2 | 0.2 |
C��CO2��/mol/L | 0.1 | 0.1 | 0.2 |
A. ƽ��ʱ������CO2��ת���ʴ���50��
B. ����Ӧƽ��ʱ������c��CO2���Ǽ��е�2��
C. �¶�����800�棬������Ӧƽ�ⳣ��Ϊ25/16��������ӦΪ���ȷ�Ӧ
D. �����������䣬����ʼʱ���������г���0.10mol/L H2��0.20 mol/L CO2������ƽ��ʱc (CO)���Ҳ�ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com