
����Ŀ��(1)�����������ʣ�ά����A��ά����C����Ԫ�ء���Ԫ�ء����ۡ���֬����ѡ����ȷ��������Ӧ�Ŀո��
������ȱ��ij��ά���ػ�����Ѫ��������ά������________��
������ȱ��ij����Ԫ�ػᷢ��ƶѪ��������Ԫ����________��
�ۼ���Ϊ�����ṩ�����������ṩ����֬�����������________��
(2)��������Ҫ��ѭ����������������Դ����ԭ��Ŀǰ���õķ�����________��________��________�����ַ����������ס�
(3)�����ڳ�ʪ�Ŀ�����ܿ�ͱ���ʴ��ԭ�����ڸ����ı����γ���һ��������Һ�ı�Ĥ���������������������̼��������С��ԭ��أ���д��������������Ҫ�ĵ缫��Ӧʽ������________����________��
(4)��ʳ�е���������������ת���������Ƕ������գ�һ���������������ڱ������ֽ⣬�ͷų���������д���÷�Ӧ�Ļ�ѧ����ʽ��________�������Ǿ��л�ԭ�ԣ�����������Һ����������Ӧ������������ҺʱӦ��2%ϡ��ˮ��μ���1 mL2%AgNO3��Һ�У���________Ϊֹ���ټ���1 mL10%��������Һ����ˮԡ����3��5min���۲쵽���������ɣ���д����������Ӧ�Ļ�ѧ����ʽ��________��
���𰸡�ά����C ��Ԫ�� ��֬ �������� �ѷ� ���� O2+4e-+2H2O��4OH�� Fe��2e-��Fe2+ C6H12O6+6O2��6CO2+6H2O ��������ij���ǡ���ܽ� CH2OH(CHOH)4CHO+2Ag(NH3)2OH![]() CH2OH(CHOH)4COONH4+H2O+2Ag��+3NH3
CH2OH(CHOH)4COONH4+H2O+2Ag��+3NH3
��������
(1)������ȱ��ά����C������Ѫ����������ά������ά����C��
������ȱ����Ԫ�ػᷢ��ƶѪ����������Ԫ������Ԫ�أ�
����֬�Ǽ���Ϊ�����ṩ�����������ṩ����֬��������ʣ���������������֬��
(2)Ŀǰ�������������õķ��������������ѷʷ��ͷ��շ������ַ����������ף�
(3)�����е�����̼������ˮ����ԭ��أ����Ը����ܷ����绯ѧ��ʴ���ڸ�ԭ����У�����������̼��������������̼�������õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ��O2+4e-+2H2O��4OH-���ڸ������ϣ���ʧ���ӷ���������Ӧ���缫��ӦʽΪ��Fe-2e-��Fe2+��
(4)�����������ڷ��������������ɶ�����̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��C6H12O6+6O2��6CO2+6H2O������������ҺʱӦ��ϡ��ˮ��μ���AgNO3��Һ�У�����������ij���ǡ���ܽ�Ϊֹ����������������Һ��ˮԡ���������·���������ԭ��Ӧ��CH2OH(CHOH)4CHO+2Ag(NH3)2OH![]() CH2OH(CHOH)4COONH4+H2O+2Ag��+3NH3��
CH2OH(CHOH)4COONH4+H2O+2Ag��+3NH3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ�����������ó��Ľ�����ȷ����( )
ѡ�� | ʵ����� | ʵ������ | ���� |
A | ������ | ������ʹʪ�����ɫʯ����ֽ��� | �ȴ�����ˮ�е���� |
B | ���������ᴦ���� | �����ɳ�ɫ��Ϊ��ɫ | �Ҵ����������� |
C | �� | ������ɫ���� | ������������� |
D | ����������ȼ�ճ��е�ȼ��Ѹ�����뼯�� | �����������̣�ƿ���к�ɫ�������� |
|
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2SO2��g��+O2��g��2SO3��g����H=��197kJmol��1������ͬ��ʽ��ס��Һͱ�3����ͬ������Ͷ�뷴Ӧ��ұ��ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й����������
���� | �� | �� | �� |
��Ӧ��Ͷ���� | 2molSO2��1molO2 | 1molSO2��0.5molO2 | 2molSO3 |
ƽ�ⳣ�� | K1 | K2 | K3 |
��Ӧ�������仯 | �ų�akJ | �ų�bkJ | ����ckJ |
�����ܶ� | ��1 | ��2 | ��3 |
��Ӧ��ת���� | ��1 | ��2 | ��3 |
�����йع�ϵʽ��ȷ���ǣ� ��
A. K1=K3��K2 B. ��1=��3����2 C. ��2+��3��1 D. 2b+c��197
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����º��������£����������в��ǿ��淴Ӧ2A��g��+3B��g��![]() 2C��g���ﵽƽ��ı�־����
2C��g���ﵽƽ��ı�־����
��C������������C�ķֽ������������λʱ������amolA��ͬʱ����1.5molB��������ֵ�Ũ�Ȳ��ٱ仯�������������ܶȲ��ٱ仯��������������ѹǿ���ٱ仯���������������ʵ������ٱ仯������������ƽ��Ħ���������ٱ仯����A��B��C�ķ�����Ŀ��Ϊ2: 3: 2.
A. �ݢޢ� B. �ڢݢ� C. �٢ۢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦA(g)��B(g)![]() 2C(g)�ڲ�ͬ�¶��¾���һ��ʱ�䣬�������C������������¶ȵĹ�ϵ��ͼ��ʾ��
2C(g)�ڲ�ͬ�¶��¾���һ��ʱ�䣬�������C������������¶ȵĹ�ϵ��ͼ��ʾ��

��1����T1��T2�仯ʱ������Ӧ����_______�淴Ӧ����(����>����<������=��)��
��2����T3��T4�仯ʱ������Ӧ����_______�淴Ӧ����(����>����<������=��)��
��3����Ӧ��_________�¶��´ﵽƽ�⡣
��4���˷�Ӧ������ӦΪ_______�ȷ�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��ŵ������ѧ������������ӵ�ؿ�������λ��ѧ�ҡ�һ������ӵ�صĽṹ��ͼ��ʾ����ط�ӦʽΪ LixC6 + Li1-xCoO2![]() C6+LiCoO2(x<1)������˵����ȷ���ǣ� ��
C6+LiCoO2(x<1)������˵����ȷ���ǣ� ��
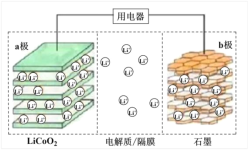
A.���ʱ a �������Դ�ĸ���
B.�ŵ�ʱLi+�ڵ��������b����a��Ǩ��
C.���ʱ��ת��0.02 mol���ӣ�ʯī�缫������0.14 g
D.�÷Ͼɵ�ؽ������ŵ紦�������������ʯī������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�����Ǻϳ����������Ȼ�������Ҫ����,ij�����V�ϳ�·������:
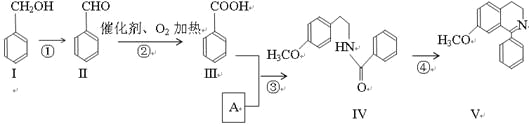
��1�����к��������ŵ�����___________��
��2����Ӧ�ڵĻ�ѧ����ʽ__________________________________��
��3����͢���Ũ���������ʱ��Ӧ�Ļ�ѧ����ʽ______________��
��4������˵����ȷ����___��
A����͢������ڷ����� B�����ܷ���������Ӧ
C��������4molH2�����ӳɷ�Ӧ D����Ӧ������������Ӧ
��5��A�Ľṹ��ʽ___��
��6�������Ϊͬ���칹��,����FeCl3������ɫ��Ӧ,�䱽���ϵ�һ�ȴ���ֻ��2�֡�д���������������Ģ��Ľṹ��ʽ___________��
��7��һ��������,�������(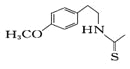 )Ҳ�ܷ������Ʒ�Ӧ�ܵĻ�����Ӧ,���Ļ�������Ľṹ��ʽ____��
)Ҳ�ܷ������Ʒ�Ӧ�ܵĻ�����Ӧ,���Ļ�������Ľṹ��ʽ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A.��ϡ������Һ�м�������ϡ��ˮ������������Ϊ���ܷ���ȡ����Ӧ
B.ʵ���ҽ���ʯ�͵�����������������ȡ����ϩ����ȡʵ��ʱ����Ҫʹ���¶ȼ�
C.�����ȵ�ͭ˿Ѹ�ٲ����Ҵ��У�������Σ��ɹ۲쵽ͭ˿�����ڣ������ŵ���ζ
D.��ǿ������ʢ��CH4��Cl2�������1��4���ļ���ƿ�ɹ۲쵽ƿ�ڱڸ�����״��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�ֱ�ը����ǿ������ըҩ����TNT����1.5��������Ũ��������������Ʒ�õ�������ͬʱ��������狀ͼ�ȩ(HCHO)������˵������ȷ���ǣ� ��
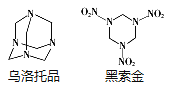
A.������Ʒ�ķ���ʽΪC6H12N4
B.������Ʒ���ӽṹ�к���3����Ԫ��
C.������Ʒ��һ�ȴ���ֻ��һ��
D.������Ʒ�õ�������Ӧ��������Ʒ����������ʵ���֮��Ϊ1��4
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com