
【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 甲烷与 | 产物能使湿润的蓝色石蕊试纸变红 | 氯代烷在水中电离出 |
B | 向填有硫酸处理的 | 固体由橙色变为绿色 | 乙醇具有氧化性 |
C | 向 | 产生黑色沉淀 | 硫酸的酸性弱于 |
D | 将金属钠在燃烧匙中点燃,迅速伸入集满 | 产生大量白烟,瓶内有黑色颗粒产生 |
|
A.AB.BC.CD.D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】天津危险品仓库起火引发爆炸,产生的CN-污染可用右图所示装置除去含CN-废水中的CN-,控制溶液pH为9~10并加入食盐,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
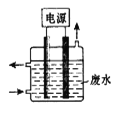
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁工业是国家工业的支柱,每年钢铁生锈让国家损失大量资金,请回答钢铁腐蚀与防护过程中的有关问题。在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图为:
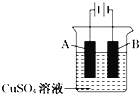
(1)A电极对应的金属是________(写元素名称),B电极的电极反应式是________;
(2)若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为________;
(3)镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种半导体材料,属于稀散金属,被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”,是当代高技术新材料的支撑材料。以碲化亚铜渣(主要物相为Cu2Te、Cu、CuSO45H2O、Au、Ag等)为原料提取与制备TeO2和单质Te的工艺流程如图所示:
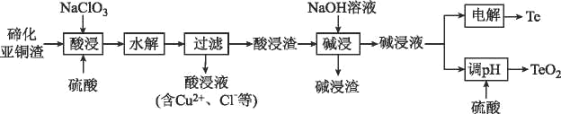
已知:“水解”反应为H2TeO3(亚碲酸)=TeO2↓+H2O。
回答下列问题:
(1)Cu2Te中Te的化合价为___。
(2)“酸浸”时,要使6molCu溶解,与Cu反应的NaC1O3的物质的量为___。
(3)写出“酸浸”时Cu2Te发生转化的离子方程式:___。
(4)取碲化亚铜渣100g,氯酸钠添加质量和硫酸浓度对碲化亚铜渣浸出效果的影响如图所示:

选择最佳的氯酸钠添加质量为___g,选择硫酸的浓度约为___mol/L(保留小数点后一位)。
(5)“碱浸渣”中含有的金属单质主要有___(填化学式),具有很高的经济利用价值。
(6)“碱浸液”利用硫酸调节溶液pH至5.5,沉淀出TeO2,该过程的离子方程式为____。
(7)电沉积法是工业中制备纯Te的常用方法,以不锈钢板和普通铁板作阴、阳极,在一定的电流密度、温度下电解碱浸液,碲元素以金属Te形式在阴极析出,则阴极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔加氢是乙烯工业中的重要精制反应,利用这一反应可以将乙烯产品中的乙炔含量降低,以避免后续乙烯聚合催化剂的中毒,工业上称为碳二加氢过程。
已知:I. ![]()
![]() ;
;
II. ![]()
![]() ;
;
回答下列问题:
(1)已知几种化学键的键能如表所示:
化学键 |
|
|
|
|
键能/ | 436 | 413.4 | 615 | 812 |
![]() =____________
=____________![]() 。
。
(2)400K时,在密闭容器中将等物质的量的![]() 和
和![]() 混合,采用适当的催化剂进行反应,生成
混合,采用适当的催化剂进行反应,生成![]() ,达到平衡时测得
,达到平衡时测得![]() ,则平衡时
,则平衡时![]() _____
_____![]() 。
。
(3)据前人研究发现乙炔在![]() 团簇表面催化加氢反应的部分历程如图所示,其中吸附在
团簇表面催化加氢反应的部分历程如图所示,其中吸附在![]() 表面上的物种用*标注。
表面上的物种用*标注。

推测乙烯在![]() 表面上的吸附为__________(填“放热”或“吸热”)过程。图中历程中最大能垒(活化能)E正=______
表面上的吸附为__________(填“放热”或“吸热”)过程。图中历程中最大能垒(活化能)E正=______![]() ,该步骤的化学方程式为___________。
,该步骤的化学方程式为___________。
(4)![]() 时,将体积比为1:2的
时,将体积比为1:2的![]() 和
和![]() 充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为
充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为![]() ,实验测得
,实验测得![]() 的分压
的分压![]() 与反应时间
与反应时间![]() 的关系如图所示:
的关系如图所示:
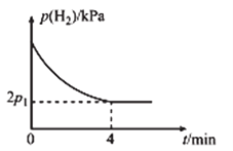
①![]() 时,
时,![]() 内,平均反应速率
内,平均反应速率![]() ______
______![]() (用含
(用含![]() 的代数式表示,下同)。
的代数式表示,下同)。
②![]() 时,该反应的化学平衡常数
时,该反应的化学平衡常数![]() _____
_____![]() (
(![]() 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
③![]() 时,
时,![]() 内,
内,![]() 的减小量______(填“>”“<”或“=”)
的减小量______(填“>”“<”或“=”) ![]() 内
内![]() 的减小量,理由为__________。
的减小量,理由为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电子排布图正确的是( )
A.O原子的电子排布图![]()
B.基态镁原子的电子排布图为![]()
C.基态磷原子的最外层电子排布图为![]()
D.基态铜原子最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.20 g D2O和18 g H2O中含有的质子数均为10NA
B.2 L 0.5 mol·L-1亚硫酸溶液中含有的H+数为2NA
C.标准状况下,22.4 L水中含有的共价键数为2NA
D.50 mL 12 mol·L-1的浓盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列物质:维生素A、维生素C、碘元素、铁元素、淀粉、油脂。请选择正确答案填在相应的空格里。
①人体缺乏某种维生素会引起坏血病,这种维生素是________;
②人体缺乏某种微量元素会发生贫血,这种微量元素是________;
③既能为人体提供热量,又能提供必需脂肪酸的物质是________;
(2)垃圾处理要遵循无害化、减量化和资源化的原则,目前常用的方法有________、________和________,三种方法各有利弊。
(3)钢铁在潮湿的空气里很快就被腐蚀,原因是在钢铁的表面形成了一层电解质溶液的薄膜,跟钢铁里的铁和少量的碳构成无数微小的原电池,请写出两极发生的主要的电极反应式:正极________负极________;
(4)粮食中的糖类在人体中能转化成葡萄糖而被吸收,一部分葡萄糖在体内被氧化分解,释放出能量,请写出该反应的化学方程式:________。葡萄糖具有还原性,能与银氨溶液发生银镜反应,配制银氨溶液时应将2%稀氨水逐滴加入1 mL2%AgNO3溶液中,到________为止,再加入1 mL10%葡萄糖溶液,振荡,水浴加热3~5min,观察到有银镜生成,请写出该银镜反应的化学方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com