
【题目】钛及其化合物的应用正越来越受到人们的关注。
(1)基态下原子核外电子排布的最高能级的符号是_____________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是________________________。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是______________(填化学式)。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如右图所示。
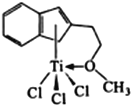
①组成该物质的元素中,电负性最大的是____________ (填元素名称)。
②M中,碳原子的杂化形式有________种。
③M中,不含_________(填标号)。
a. π键 b. σ键 c.配位键 d.氢键 e.离子键
(5)金红石(TiO2)是含钛的主要矿物之一,具有四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如下图所示。
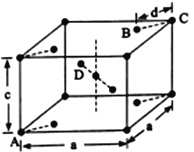
①4个微粒A、B、C、D中,属于氧原子的是______________。
②若A、B、C的原子坐标分别为A (0,0,0)、B (0.69a,0.69a,c)、c (a, a,c),则D的原子坐标为D (0.19a,_____,______);钛氧键的键长d=________________(用代数式表示)。
【答案】 3d 3 Ti原子的价电子数比Al多,金属键更强)((或Ti的原子化热比Al大,金属键更强等其他合理答案) SiCl4 氧 2 d、e BD 0.81a 0.5c 0.31×![]() a
a
【解析】(1)基态 Ti 原子核外电排布为 1S 22S 22P 63S 23P 63d 24S 2,且未成对电子数为2,基态下原子核外电子排布的最高能级的符号是3d。第 4周期元素中,基态原子的未成对电数与钛相同的有 Ni (3d 84S 2)、 Ge (4S 24P 2)、 Se (4S 24P 4)3种;(2)钛与铝同为金属晶体,金属晶体的硬度主要由金属键决定,钛硬度比铝大的原因是Ti原子的价电子数比Al多,金属键更强)(或Ti的原子化热比Al大,金属键更强等其他合理答案)。(3)由TiCl4和 SiCl 4在常温下都是液体,可知,两者均属于分子晶体且分子结构相同,分子间作用力是影响晶体物理性质的主要因素,相对分子质量越大分子间作用力越大,所以,TiCl4比SiCl 4沸点高。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是SiCl 4;。
(4)半夹心结构催化剂M中含有C、H、0、Ti、Cl 五种元素,电负性大小顺序为O>Cl>C>H>Ti,①组成该物质的元素中,电负性最大的是 氧。;碳原子的杂化形式有sp2、sp3两种,②M中,碳原子的杂化形式有2种;在半夹心分子结构中,C-C、C-H、C-O原子间存在δ键,环中存在大π键、Ti 与O间存在配位键,不存在氢键与离子键。③M中,不含de。(5)晶体结构有7大晶系,每个晶胞含有6个晶胞参数(棱长a、b、c; 夹角αβγ),金红石(TiO2) 是典型的四方晶系,结构中A类原子8×1/8=1、B类原子4×1/2=2、D类原子2×1=2、体心原子1×1=1,原子B、D为O,①4个微粒A、B、C、D中,属于氧原子的是BD;原子A与体心原子为Ti (Ti :O= 1:2)。结合晶系与晶胞参数可得原子坐标可A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c)、D(0.19a,0.81a, 0.5c)、体心(0.5a,0.5a,0.5c)。钛氧键键长:d2=(0.31a)2+ (0.31a)2,则d= 0.31×![]() a。
a。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 含有非极性键的分子一定是非极性分子
B. 非极性分子中一定含有非极性键
C. 由极性键形成的双原子分子一定是极性分子
D. 两个原子之间共用两对电子,形成的化学键一定有极性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图。

① 下列对尼泊金酯的判断不正确的是______。
a.能发生水解反应
b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上
d.与浓溴水反应时,1 mol尼泊金酯消耗1 mol Br2
e.1 mol尼泊金酯与足量浓溴水反应后,使其有机产物与NaOH溶液反应,则最多消耗6 mol NaOH溶液。
② 尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是____________________________,其中包含的反应类型有_________________、________________。
(2)C8H8O3的另一种同分异构体甲满足以下条件:① 与足量的NaOH溶液完全反应时,1 mol甲消耗3 molNaOH,② 遇FeCl3溶液显色,③ 苯环上的一氯取代物只有一种。
甲可能的结构简式是_______________、____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检测明矾样晶(含砷酸盐)中的砷含量是否超标,实验装置如下图所示(夹持装置已略去)。
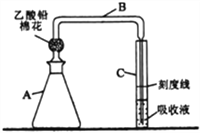
【实验1】配制砷标准溶液
①取0.132gAg2O3,用NaOH溶液完全溶解后,配制成1LNa3AsO3溶液(此溶液1mL相当于0.10mg砷);
②取一定量上述溶液,配制1L含砷量为1mg·L-1的砷标准溶液。
(1)步骤①中,必须使用的玻璃仪器除烧杯、玻璃棒外,还有__________。步骤②需取用步骤①中Na3AsO3溶液____mL。
【实验2】制备砷标准对照液
①往A瓶中加入2.00mL砷标准溶液,再依次加入一定量的盐酸、KI溶液和SnCl2溶液,混匀,室温放置10 min,使砷元素全部转化为H3AsO3。
②往A瓶中加入足量锌粒(含有ZnS杂质),立即塞上装有乙酸铅棉花的导气管B,并使B管右侧末端插入比色管C中银盐吸收液的液面下,控制反应温度25~40℃,45 min后,生成的砷化氢气体被完全吸收,Ag+被还原为红色胶态银。
③取出C管,向其中添加氯仿至刻度线,混匀,得到砷标准对照液。
(2)乙酸铅棉花的作用是_____________________。
(3)完成生成砷化氢反应的离子方程式:
____Zn+____H3AsO3+____H+=____( )+ ____Zn2++____( )________________
(4)控制A 瓶中反应温度的方法是________________________;反应中,A瓶有较多氢气产生,氢气除了搅拌作用外,还具有的作用是_____________________________。
(5)B管右侧末端导管口径不能过大(约为1mm),原因是__________________________。
【实验3】判断样品中砷含量是否超标
称取ag明矾样品替代【实验2】 ①中“2.00m砷标准溶液”,重复【实验2】后续操作。将实验所得液体与砷标准对照液比对,若所得液体的颜色浅,说明该样品含砷量未超标,反之则超标。
(6)国标规定砷限量为百万分之二(质量分数),则a的值为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙偶姻是一个极其重要的香料品种,主要用于配制奶香型、肉香型、草莓香型香精,也可用于合成其他精细化学品。已知乙偶姻中只含有C、H、O三种元素,其相对分子质量为88,分子中C、H、O原子个数比为2:4:1 。
请回答:
(1)乙偶姻的分子式为___________。
(2)X是乙偶姻的同分异构体,属于酯类,写出其结构简式(两种即可)_____________。
已知:
乙偶姻中含有碳氧双键。与乙偶姻有关的反应如下:

(3)写出反应①、②的反应类型:反应① ___________、反应② ___________。
(4)A的一氯代物只有一种。写出A、乙偶姻、C的结构简式:
A ___________________、乙偶姻 __________________、C_________________。
(5)写出D → E反应的化学方程式_____________________________________。
(6)设计实验方案。
I.检验F中的官能团______________________________________。
II.完成反应③的转化___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
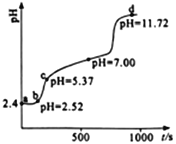
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁( PFS)是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣(有效成分为Fe2O3和Fe3O4)制备PFS,其工艺流程如下图所示。
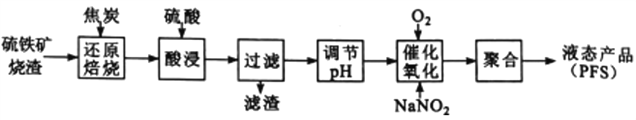
(1)“还原焙烧”过程中,CO还原Fe3O4生成FeO的热化学方程式为__ 。
已知: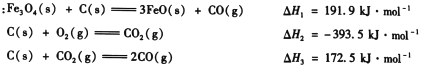
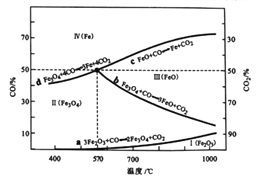
(2) CO是“还原焙烧”过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,I、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3. Fe3O4. FeO、Fe稳定存在的区域。a属于____(填
“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K=______。
(3)工业上,“还原焙烧”的温度一般控制在800℃左右,温度不宜过高的理由是____。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是_____ 。
(5)已知![]() 若浸出液中
若浸出液中![]() ,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤___。
,为避免“催化氧化”过程中产生Fe(OH)3,应调节浸出液的pH≤___。
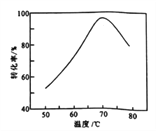
(6) FeS04溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为____。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是 __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)有一种溶液,除含H+、OH- 外,还含有Na+、SO42- 和Cl-,测得Na+、SO42- 和Cl-三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH近似为____________。
(2)NH4Cl溶液显酸性,试用离子方程式表示这一原理______________ 。
(3)液氨的电离类似于水,试写出液氨的电离方程式_______________;在液氨中加入NH4Cl,平衡将向_________移动。
(4)氯化银在水中存在沉淀溶解平衡: AgCl(s)![]() Ag+(aq)+Cl-(aq), 在25℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 0.1 mol·L-1氯化镁溶液中;②100 mL蒸馏水中;③100 mL 0.1 mol·L-1硝酸银溶液中;④100 mL 0.1 mol·L-1盐酸溶液中。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是____________(填写序号)。
Ag+(aq)+Cl-(aq), 在25℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 0.1 mol·L-1氯化镁溶液中;②100 mL蒸馏水中;③100 mL 0.1 mol·L-1硝酸银溶液中;④100 mL 0.1 mol·L-1盐酸溶液中。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是____________(填写序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com