
【题目】回答下列问题:
(1)有一种溶液,除含H+、OH- 外,还含有Na+、SO42- 和Cl-,测得Na+、SO42- 和Cl-三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH近似为____________。
(2)NH4Cl溶液显酸性,试用离子方程式表示这一原理______________ 。
(3)液氨的电离类似于水,试写出液氨的电离方程式_______________;在液氨中加入NH4Cl,平衡将向_________移动。
(4)氯化银在水中存在沉淀溶解平衡: AgCl(s)![]() Ag+(aq)+Cl-(aq), 在25℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 0.1 mol·L-1氯化镁溶液中;②100 mL蒸馏水中;③100 mL 0.1 mol·L-1硝酸银溶液中;④100 mL 0.1 mol·L-1盐酸溶液中。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是____________(填写序号)。
Ag+(aq)+Cl-(aq), 在25℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 0.1 mol·L-1氯化镁溶液中;②100 mL蒸馏水中;③100 mL 0.1 mol·L-1硝酸银溶液中;④100 mL 0.1 mol·L-1盐酸溶液中。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是____________(填写序号)。
【答案】 3 H2O+NH4+![]() NH3·H2O+H+ 2NH3
NH3·H2O+H+ 2NH3![]() NH
NH![]() +NH
+NH![]() 逆反应方向(或左) ③②④①
逆反应方向(或左) ③②④①
【解析】(1)忽略氢氧根的浓度根据电荷守恒可知溶液中氢离子浓度是0.004mol/L+0.0035mol/L×2-0.01mol/L=0.001mol/L,所以该溶液的pH近似为3;(2)NH4Cl是强酸弱碱盐,铵根水解,溶液显酸性,离子方程式为H2O+NH4+![]() NH3·H2O+H+。(3)液氨的电离类似于水,则液氨的电离方程式为2NH3
NH3·H2O+H+。(3)液氨的电离类似于水,则液氨的电离方程式为2NH3![]() NH4++NH2-;在液氨中加入NH4Cl,铵根浓度增大,平衡将向逆反应方向移动。(4)溶液中氯离子浓度越大,则相应银离子浓度越小,①100 mL 0.1 mol·L-1氯化镁溶液中氯离子浓度是0.2mol/L;②100 mL蒸馏水中;③100 mL 0.1 mol·L-1硝酸银溶液中;④100 mL 0.1 mol·L-1盐酸溶液中氯离子浓度是0.1mol/L,所以充分搅拌后,相同温度下Ag+浓度由大到小的顺序是③②④①。
NH4++NH2-;在液氨中加入NH4Cl,铵根浓度增大,平衡将向逆反应方向移动。(4)溶液中氯离子浓度越大,则相应银离子浓度越小,①100 mL 0.1 mol·L-1氯化镁溶液中氯离子浓度是0.2mol/L;②100 mL蒸馏水中;③100 mL 0.1 mol·L-1硝酸银溶液中;④100 mL 0.1 mol·L-1盐酸溶液中氯离子浓度是0.1mol/L,所以充分搅拌后,相同温度下Ag+浓度由大到小的顺序是③②④①。


科目:高中化学 来源: 题型:
【题目】钛及其化合物的应用正越来越受到人们的关注。
(1)基态下原子核外电子排布的最高能级的符号是_____________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_____种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是________________________。
(3)TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是______________(填化学式)。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如右图所示。
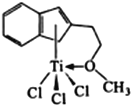
①组成该物质的元素中,电负性最大的是____________ (填元素名称)。
②M中,碳原子的杂化形式有________种。
③M中,不含_________(填标号)。
a. π键 b. σ键 c.配位键 d.氢键 e.离子键
(5)金红石(TiO2)是含钛的主要矿物之一,具有四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如下图所示。
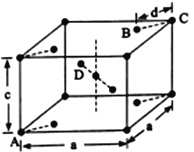
①4个微粒A、B、C、D中,属于氧原子的是______________。
②若A、B、C的原子坐标分别为A (0,0,0)、B (0.69a,0.69a,c)、c (a, a,c),则D的原子坐标为D (0.19a,_____,______);钛氧键的键长d=________________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含原子数相同的是:( )
A. 8gH2和8gO2 B. 5.6LN2(标况)和11gCO2
C. 2.24LH2(标况)和0.1molN2 D. 9gH2O和0.5molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积相同的两个密闭容器中分别充满C2H4和C3H6气体,当这两个密闭容器中温度和气体密度相等时,下列说法正确的是
A. 两种气体的分子数相等 B. C2H4比C3H6的质量小
C. 两种气体的压强相等 D. 两种气体的原子数相等.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bm﹣、Cn﹣具有相同的电子层结构,且n<m,则下列关系正确的是( )
A.a>b>c
B.b>a>c
C.a=b+m+n
D.a=c﹣n﹣m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式_____________________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH______________ (填“大”、“小”或“相等”) 。
(3)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为_____________________________________ 。
(4)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为________________。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe(OH)3胶体微粒能吸附Fe3+离子。在约50mL的沸水中,滴入8—10滴(20滴约为1mL)饱和FeCl3溶液至其为红褐色后,将它们装入半透膜袋中,并浸没在盛有蒸馏水的烧杯中。隔一段时间后,烧杯里的水中含有的离子最多的是 ( )
A. H+、OH- B. H+、Cl- C. Fe3+、Cl- D. Fe3+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某型甲醇燃料电池的总反应式2CH40+302=2C02↑+4H20,下图是该燃料电池的示意图。
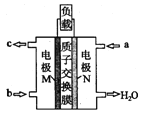
下列说法错误的是
A.燃料电池将化学能转化为电能
B.a是甲醇,b是氧气
C.质子从M电极区穿过交换膜移向N电极区
D.负极反应:CH40-6e-+H20=C02↑+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池能有效提高能源利用率,具有广泛的应用前景.下列物质均可用作燃料电池的燃料,其中最环保的是( )
A.一氧化碳
B.天然气
C.乙醇
D.氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com