
【题目】25℃,已知KSp(AgCl)=1.8×10-10,将2×10-5mol/L的AgNO3溶液和2×10-5mol/L的KCl溶液等体积混合,下列说法正确的是( )
A. 恰好形成AgCl饱和溶液 B. 能析出AgCl沉淀
C. 不能析出AgCl沉淀 D. 无法确定能否析出AgCl沉淀
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾在异丙醇中溶解度非常小。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是__________________________________。
②反应Ⅱ的离子方程式为__________________________________________________。
③已知25 ℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=_______ 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,析出后溶液中c(K+)<c(Na+)。由以上信息可知______(填字母)。
A.高铁酸钾的溶解度比高铁酸钠大 B.Ksp(K2FeO4)<Ksp(Na2FeO4)
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为__________________。
(4) 锌-锰碱性电池以KOH溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s)。
Zn--K2FeO4 也可以组成碱性电池,与 Zn--MnO2电池类似。K2FeO4在电池中作正极材料,其电极反应式为__________________________________________________________,该电池总反应的离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某环保部门处理含CN-电镀废水的方法如图(CN-和CNO-中N的化合价均为-3价):
![]()
![]()
![]()
![]()
![]()
某学习小组依据上述方法,用下图实验装置进行该电镀废水处理的研究。

操作步骤:
ⅰ.先关闭装置甲的开关,再将含CN-废水与过量NaClO溶液混合,取200 mL混合液[其中c(CN-)=0.200mol/L]加入装置甲中,塞上橡皮塞。
ⅱ.待装置甲中充分反应后,打开开关,使溶液全部流入装置乙中,关闭开关。
ⅲ.测定干燥管Ⅰ增加的质量。
(1)写出装置乙中反应的离子方程式:________________________________________。
(2)装置丙中的试剂是_______________,装置丁的作用是_______________________。
(3)假定上述实验中的气体都被充分吸收。若干燥管Ⅰ增重1.408 g。则CN-被处理的百分率为__________。
(4)你认为用此装置进行实验,与(3)对比,CN-被处理的百分率将________(填“偏高”、“偏低”、“无法确定”或“无影响”),简述你的理由:________________________________。
Ⅱ.防治空气污染,燃煤脱硫很重要。目前科学家对Fe3+溶液脱硫技术的研究已取得新成果。
(5)某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10 mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去。
方案②:B中加入KSCN溶液,溶液不变红,再加入新制的氯水,溶液变红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
上述实验方案中不合理的是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示自然界中的氮循环,相关说法正确的是
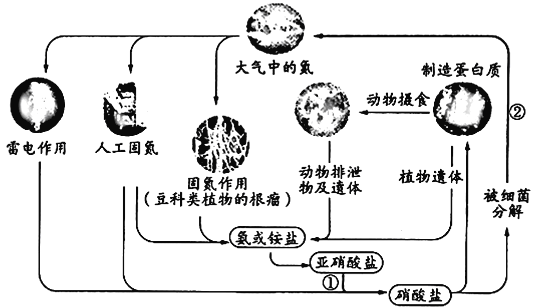
A. “雷电作用”中发生的反应是:N2+ 2O2![]() 2NO2
2NO2
B. “人工固氮”过程中,氮元素一定被还原
C. ①中涉及的反应可能有:2NO2-+O2 = 2NO3-
D. ②中涉及的反应可能有:2NO3-+12H+ = N2+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aM(g)+bN(g) ![]() cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如下图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
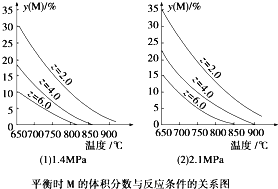
A. 同温同压Z时,加入催化剂,平衡时Q的体积分数增加
B. 同温同压时,增加Z,平衡时Q的体积分数增加
C. 同温同Z时,增加压强,平衡时Q的体积分数增加
D. 同压同Z时,升高温度,平衡时Q的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃完全燃烧时,消耗的氧气与生成的CO2体积比为3∶2,该烃能使酸性高锰酸钾溶液褪色,也能使溴水褪色,则该烃的分子式可能为
A. C3H4 B. C2H4 C. C2H6 D. C6H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验室制备乙酸乙酯和乙酸丁酯的描述中,正确的是
A.均采用水浴加热B.制备乙酸乙酯时乙醇过量
C.均采用边反应边蒸馏的方法D.制备乙酸丁酯时正丁醇过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。

A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25 L2/mol2
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com