
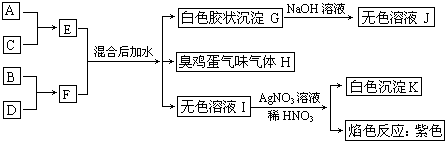
| 水 |
| 水 |
 ,故答案为:
,故答案为: ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
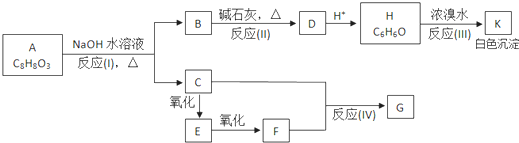
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 |
| B、1mol过氧化钠与2 mol碳酸钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是纯净物 |
| C、等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
| D、可利用焰色反应来鉴别Na2CO3和NaHCO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、做银镜反应实验后的试管内壁附有银,可用稀硝酸清洗 |
| B、向MgCl2溶液中滴加NaOH溶液,产生白色沉淀,再加入FeCl3溶液,沉淀逐渐变为红褐色 |
| C、用0.1mol/L的酸性KMnO4溶液配成的溶液滴定一定质量的草酸晶体(H2C2O4?nH2O)以测定其n值,若终点仰视读数,则n值偏大 |
| D、环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
B、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
| ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
| D、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
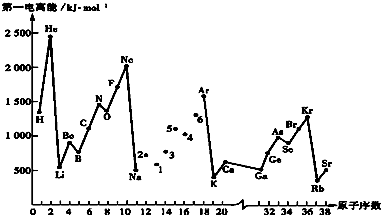
| 共价键 | H-H | Cl-Cl | Br-Br | H-Cl | H-I | I-I | N≡N | H-O | H-N |
| 键 能 | 436 | 247 | 193 | 431 | 299 | 151 | 946 | 463 | 391 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com