
����Ŀ�����ݻ�ѧ�ܺ����ܡ�������ص�֪ʶ����ش��������⣺
I����֪31 g����(P4)��Ϊ31 g����(P)ʱ�ͷ������������仯����__________�仯(����������������ѧ��)���ȶ�����_________����(����>������<��)��
II��������һ�������Դ�����ҹ����칤����Ҳ��Ӧ�á�
(1)��֪1g����ȼ��������̬ˮ�ų�����121kJ�����ж���1molH��H������436kJ������1molO��O������496kJ����ô�γ�1molH��O���ų���__��
(2)���켼����ʹ�õ��⣭��ȼ�ϵ��ԭ�����Լ�����ͼ���⣭��ȼ�ϵ�ص�װ��ͼ�� ��
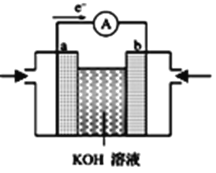
��a��Ϊ��ص�______(��������������������)����Һ��OH������_______�缫������a������b������
�ڷŵ�ʱ��b�缫����pH_______��(������С��)��
�����H2��Ϊ���飬�ܷ�ӦΪ��CH4+ 2O2 + 2OH- = CO32- + 3H2O�����缫��ӦʽΪ��_________��
���𰸡���ѧ �� 463kJ ���� a ���� CH4��8e����10OH����CO32-��7H2O
��������
���ͺ����Dz�ͬ�����ʣ�����ױ�Ϊ�����ǻ�ѧ�仯������ױ�Ϊ�����ͷ��������������е��������ں����е����������ʵ�����Խ��Խ�ȶ������ȶ��ԣ����ף����ף��ʴ�Ϊ����ѧ������
II��(1)1g���������ʵ���Ϊ![]() =0.5mol��ȼ��������̬ˮ�ų�����121kJ��2H2+O2
=0.5mol��ȼ��������̬ˮ�ų�����121kJ��2H2+O2![]() 2H2O����2mol����ȼ��������̬ˮ�ų�������Ϊ��121kJ��
2H2O����2mol����ȼ��������̬ˮ�ų�������Ϊ��121kJ��![]() =484kJ����2H2(g)+O2(g)
=484kJ����2H2(g)+O2(g)![]() 2H2O(g)��H=-484kJ/mol�����γ�1molH��O���ų�����Ϊx����Ӧ�ų�������=�¼������ͷŵ�����-�ɼ��������յ�����=4x -(436kJ��2+496kJ)=484kJ�����x=463 kJ���ʴ�Ϊ��463kJ��
2H2O(g)��H=-484kJ/mol�����γ�1molH��O���ų�����Ϊx����Ӧ�ų�������=�¼������ͷŵ�����-�ɼ��������յ�����=4x -(436kJ��2+496kJ)=484kJ�����x=463 kJ���ʴ�Ϊ��463kJ��
(2)��ԭ����е��ӴӸ���������������֪ͼ�е��Ӵ�a����b����a Ϊ������bΪ��������Һ�����������ƶ�������Һ��OH-����a��
�ʴ�Ϊ��������a��
������ȼ�ϵ���������������ϵõ��ӣ���缫��ӦʽΪ��O2+2H2O+4e-=4OH-��b�缫������Һ�ļ�����ǿ��pH���ʴ�Ϊ������
�����H2��Ϊ���飬�����ܷ�ӦCH4+ 2O2 + 2OH- = CO32- + 3H2O�������缫��ӦʽΪCH4��8e����10OH����CO32-��7H2O���ʴ�Ϊ��CH4��8e����10OH����CO32-��7H2O��


 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ˮ��Al3�������IJⶨ�ʹ����ǻ�����������Ҫ���⡣
(1)���ҵ��ˮ�м���NaOH��Һ�����������ܽ⣬�ټ���һ������NaHCO3��Һ���裬��Ӧ����˿����ʯ[NaAl(OH)2CO3]���������˳�ȥ��д������NaHCO3��Һ����˿����ʯ���������ӷ���ʽ��____________________________________��
(2) Ϊȷ������NaHCO3��Һ��������ⶨ��ҵ��ˮ��Al3���ĺ�������ҵ�ϳ�����EDTA��ϵζ������������£�
����1��CuSO4��Һ��������궨��ȡһ������������ˮ����������ϡH2SO4��ת�Ƶ�1 L����ƿ�ж��ݡ�ȷ��ȡ25.00 mL������Һ����250 mL��ƿ�У���0.005 0 mol��L��1EDTA��Һ�ζ����յ㡣�ظ�3��ʵ�飬ƽ������EDTA��Һ10.00 mL ��
����2����Ʒ������ȡ10.00 mL��ҵ��ˮ����250 mL��ƿ�У�����һ����������ᣬ��У��ټ���0.005 0 mol��L��1��EDTA��Һ20.00 mL��������ҺpH��4.0�����ȣ���ȴ����CuSO4��Һ�ζ����յ㣬����CuSO4��Һ30.00 mL��(��֪��Cu2+��Al3+��EDTA��Ӧ�Ļ�ѧ�����Ⱦ�Ϊ1��1)
����1�У��ظ�3��ʵ���Ŀ����____________________________��
�� Fe3��Ҳ����EDTA��Ӧ������2�м��������������Ϊ�ڱμ�������Fe3+�ĸ��š����ÿ�ҵ��ˮ��Ʒ�к���Fe3+��������ʵ����δ���������ᣬ��ⶨ��Al3+������________(����ƫ������ƫС��������Ӱ����)��
�ۼ���ÿ�ҵ��ˮ��Al3���ĺ���____________(��mg��L��1��ʾ)(д���������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��������(��Ҫ�ɷ�ΪNiO������������FeO��Fe2O3��CoO��SiO2��)Ϊԭ���Ʊ�NixOy��̼����Ĺ����������£�
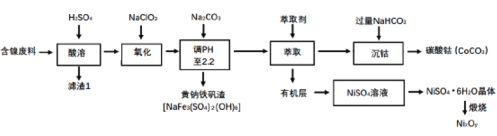
(1)��������ʱ�轫�������Ϸ��飬Ŀ����___������CoCO3�IJ���������ʵ���ҹ۲��Ԫ�ص���ɫ��Ӧ���ò�������ɫΪ____��
(2)��������������NaClO3��������____��Ϊ֤������NaClO3������������____ (д��ѧʽ)��Һ���м��顣
(3)����pH�����������ɻ�����������(NaFe3(SO4)2(OH)6)�������ӷ���ʽΪ_____��
(4)�����������̵����ӷ���ʽ__����������������ʼʱc(Co2+)=0.10 mol/L�������pH��__ʱ�������Co(OH)2������(��֪Ksp��Co(OH)2]=4.0��10-15��lg2=0.3)��
(5)��NiSO4��Һ���NiSO4��6H2O����IJ��������ǣ�����Ũ����Һ���о�Ĥ���֣�_____�����ˣ�ϴ�ӣ������������ʱʣ������������¶ȱ仯������ͼ����������B������ʾ������(NixOy)�Ļ�ѧʽΪ____��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���طŵ硢���ʱ��ӦΪ��Fe + Ni2O3 +3H2O![]() Fe(OH)2 +2Ni(OH)2 �������ƶ�����ȷ���ǣ� ��
Fe(OH)2 +2Ni(OH)2 �������ƶ�����ȷ���ǣ� ��
A.�ŵ�ʱ�������ϵĵ缫��Ӧʽ�ǣ�Fe+2OH��-2e��=Fe (OH)2
B.�ŵ�ʱ��ÿת��2 mol ���ӣ���������1 mol Ni2O3 ������
C.���ʱ�������ϵĵ缫��Ӧʽ�ǣ�2Ni(OH)2 -2e��+ 2OH�� = Ni2O3 +3H2O
D.�����صĵ缫�����ǽ���ij�ּ��Ե������Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25�桢101 kPa�����£�C(s)��H2(g)��CH3COOH(l)�ı�ȼ���ȷֱ�Ϊ-393.5 kJ/mol��-285.8 kJ/mol��-870.3 kJ/mol����1/2CH3COOH(l) �T C(s)��H2(g)��1/2O2(g)�ķ�Ӧ��Ϊ�� ��
A. ��244.15 kJ/molB. ��488.3 kJ/molC. ��191 kJ/molD. ��191 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ�����ͼװ��̽��ʯ���ͷֽ��������ʣ�����˵���������
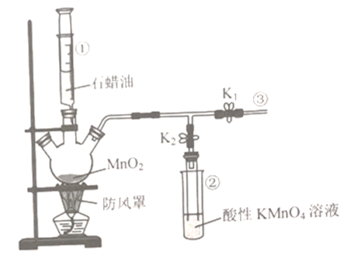
A.�����ٿɿ���ʯ���͵μӵ�����
B.װ�â�������������
C.ʵ������У��ر�K1����K2��װ�â�����Һ��ɫ����ȥ
D.����һ��ʱ��ر�K2����K1���ڢ۴���ȼ����ɿ�������ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��Ƽ��仯������й�˵������ȷ����(����)
A.����CuSO4��Һ��Ӧ�����ӷ���ʽΪ2Na+Cu2+�TCu+2Na+
B.7.8 g Na2O2��������Ϊ0.4NA
C.�������Ƽ���еļ�ָNaHCO3
D.��Na2CO3������Һ��ͨ��������CO2����NaHCO3�ᾧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Fe2O3 ��CuO�Ļ���������H2�����У����ȳ�ַ�Ӧ����ȴ��Ƶ�ʣ������ԭ��������1.6 g��������������ԭ����������ᷴӦ����ʹ֮��ȫ�ܽ⣬��1 mol/L��������������Ϊ(����)
A.0.05 LB.0.1 LC.0.2 LD.0.4 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�ӦN2O4��g��![]() 2NO2��g�����¶�һ��ʱ��ƽ����ϵ��NO2�������������NO2����ѹǿ�ı仯�����ͼ��ʾ��ʵ�����κ�һ��Ϊ��Ӧѹǿ�µ�ƽ��㣩������˵����ȷ���ǣ� ��
2NO2��g�����¶�һ��ʱ��ƽ����ϵ��NO2�������������NO2����ѹǿ�ı仯�����ͼ��ʾ��ʵ�����κ�һ��Ϊ��Ӧѹǿ�µ�ƽ��㣩������˵����ȷ���ǣ� ��
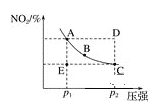
A. A��C���������Ӧ���ʵĹ�ϵΪA��C
B. A��B��C��D��E��״̬�У�v��������v���棩����״̬E
C. ʹE״̬��ˮƽ����C״̬������ƽ�����ߵ���A״̬������������������ѡ�õ������Ǵ�p1ͻȻ��ѹ��p2������p2��������ѹ��p1
D. ά��p1���䣬E��A����ʱ��Ϊx��ά��p2���䣬D��C����ʱ��Ϊy����x��y
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com