
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A.二者恰好反应生成碳酸钠和水,碳酸根离子水解但程度较小,碳酸根离子两步水解和水电离都生成氢氧根离子;
B.二者混合后,溶液中溶质为等物质的量浓度的 CH3COONa、CH3COOH和NaCl,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性,结合物料守恒判断;
C.室温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合后氨水有剩余,溶液呈碱性,但溶液中仍然存在电荷守恒,根据电荷守恒判断;
D.0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,二者恰好反应生成醋酸钠,任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:A.二者恰好反应生成碳酸钠和水,碳酸根离子水解但程度较小,碳酸根离子两步水解和水电离都生成氢氧根离子,所以c(HCO3-)<c(OH-),故A错误;
B.二者混合后,溶液中溶质为等物质的量浓度的 CH3COONa、CH3COOH和NaCl,醋酸电离程度大于醋酸根离子水解程度导致溶液呈酸性,所以c(CH3COO-)>c(CH3COOH),但其电离程度较小,结合物料守恒得c(CH3COO-)>c(Cl-)>c(CH3COOH),故B正确;
C.室温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合后氨水有剩余,溶液呈碱性c(OH-)>c(H+),但溶液中仍然存在电荷守恒,溶液中存在电荷守恒c(Cl-)+c(OH-)=c(H+)+c(NH4+),则c(Cl-)<c(NH4+),所以得c(Cl-)+c(H+)<c(NH4+)+c(OH-),故C错误;
D.0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,二者恰好反应生成醋酸钠,任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(CH3COO-)+c(OH-)=c(H+)+c(Na+),根据物料守恒得:c(Na+)=c(CH3COO-)+c(CH3COOH),所以得c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意电荷守恒、物料守恒的应用,易错选项是A,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O溶于水:Na2O+H2O=2Na++2OH- | |
| B. | 向Ca(ClO)2溶液中通入过量CO2:2ClO-+H2O+CO2=2HClO+CO32- | |
| C. | 用FeCl3溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ | |
| D. | 碳酸钙溶于稀醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
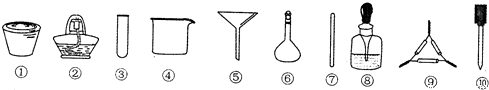
| A. | 将茶叶灼烧灰化,选用①、②和⑨ | |
| B. | 检验滤液中的Fe3+,选用③、⑧和⑩ | |
| C. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ | |
| D. | 过滤得到的滤液,选用④、⑤和⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “滴水石穿、绳锯木断”一定不涉及化学变化 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| C. | 充分开发利用天然纤维,停止使用各种化学合成材料 | |
| D. | 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2++2OH-═Mg(OH)2↓ | B. | Mg(OH)2+2H+═2Mg2++2H2O | ||
| C. | Mg(OH)2═MgO+H2O | D. | MgCl2═Mg+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个任何气体分子所占体积都约是22.4L | |
| B. | NA个H3O+含有电子数目为11NA | |
| C. | 0.5mol/L NaOH溶液中含有0.5NA个Na+ | |
| D. | NA个CO2和NO2的混合气体中氧原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
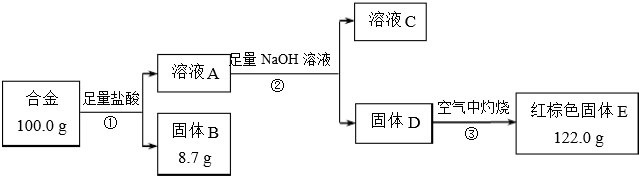
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com