
【题目】下列说法正确的是( )
A.Ksp(AB2)小于Ksp(CD),说明AB2的溶解度一定小于CD的溶解度
B.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
C.2C+SiO2![]() Si+2CO↑,此反应能够进行是因为碳的还原性比硅强
Si+2CO↑,此反应能够进行是因为碳的还原性比硅强
D.弱酸也可以通过复分解反应制强酸,如:H2S+CuSO4=H2SO4+CuS↓
 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)![]() Y(g)+Z(s),以下不能作为反应达到平衡标志的是( )
Y(g)+Z(s),以下不能作为反应达到平衡标志的是( )
A.v正(X)=2v逆(Y)B.混合气体的压强不再变化
C.混合气体的密度不再变化D.单位时间内生成lmolY的同时分解2mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有______________________(任写一种)。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_____________,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为_____________mol/L。
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____________________。
(4)“赶氨”时,最适宜的操作方法是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是

A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水溶液的一些叙述正确的是( )
A.某水溶液中,c(H+)=![]() mol/L,该溶液呈中性
mol/L,该溶液呈中性
B.已知电离常数H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11,HClO的Ka=2.95×10-8,相同温度相同浓度溶液的pH:Na2CO3<NaClO
C.常温下,向Na2S溶液中加入NaCl溶液,S2-的水解程度不受影响
D.向含有Cl-、Br-、I-的混合溶液中滴加AgNO3溶液,先产生黄色沉淀,说明c(I-)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A.取标准NaOH容液注入碱式滴定管至刻度线0以上2cm~3cm;
B.量取25.00mL.待制盐酸溶液注入洁净的锥形瓶,并加儒2~3滴酚酞;
C.用标准溶液润洗滴定管2~3次;
D.调节液面至“0”或“0”以下刻度并记下读数;
E.把盛有标准溶液的碱式滴定管周定好,调节滴定管尖嘴使之充满溶液;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记滴定管液面的刻度。
据此实验光成填空:
(1)正确操作步骤的顺序是__、__、__、__、B、__。(用序号字母填写)
(2)滴定管洗涤之前必须___,滴定过程中时,左手握滴定管的活塞,右手摇动锥形瓶,眼睛注视___,滴定达到终点的标志是___。
(3)上述B步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是___(填“偏大”“偏小”或“不变”)。
(4)若第四次滴定开始和结束时,滴定管中的液面如图所示;则所滴NaOH溶液的体积为___mL。

(5)某学生根据四次实验记录数据计算该盐酸溶液的物质的量浓度:c(HCl)=___。
滴定次数 | 盐酸(mL) | 0.1000mol/LNaOH的体积(mL) | ||
滴定前 | 滴定后 | 溶液体积 | ||
第一次 | 25.00 | 0.05 | 26.17 | 26.12 |
第二次 | 25.00 | 1.58 | 30.31 | 28.73 |
第三次 | 25.00 | 0.22 | 26.30 | 26.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.在NH4Cl饱和溶液中加入金属镁可以得到两种气体
B.pH=12 Ba(OH)2溶液中c(OH-)是0.001 mol/L NaOH溶液c(OH-)的10倍
C.常温下,CH3COONa和CH3COOH的混合溶液中(pH=7):c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
D.常温下,Cd(OH)2和Co(OH)2的混合悬浊液中,c(Cd2+)是c(Co2+)的4倍,已知:Ksp[Cd(OH)2]=7.2×10-15,Ksp[Co(OH)2]=1.8×10-15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A 是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G 之间的转化关系:
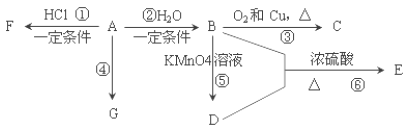
请回答下列问题:
(1)A 的官能团的名称是___________; C 的结构简式是________;
(2)E 是一种具有香味的液体, 由 B+D→E 的反应方程式为___________, 该反应类型是______________;
(3)G 是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质 F(沸点 12.27°C)进行应急处理.写出由A 制 F 的化学反应方程式______________。
(5)E 的同分异构体能与 NaHCO3溶液反应,写出该同分异构体的结构简式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________。
(2)写出实验Ⅰ反应的离子方程式:_________________。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________。
(深入探究)20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_____________(写出两条)。
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2![]() I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com