
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率____(填“升高”或“降低”),△H____0(填“>”或“<”)。
②根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=__mol·L-1·min-1;计算该反应的平衡常数K=___。
③若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
(2)工业上用CO2和H2反应合成二甲醚(CH3OCH3)。二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:______________。
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10 的溶液,则溶液c(CO32-)∶c(HCO3-)=____________。[常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
【答案】 降低 < 0.042 4.0 BC CH3OCH3 — 12e- + 16OH- = 2CO32- + 11H2O 1:2或0.5
【解析】(1)试题分析:由表中数据可知,在T1℃时,反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g)在20 min达到平衡,容器中NO、N2、CO2的浓度之比为1:2:2.
N2(g)+CO2(g)在20 min达到平衡,容器中NO、N2、CO2的浓度之比为1:2:2.
①若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则平衡向逆反应方向移动,所以该反应为放热反应,△H<0,达到新平衡时NO的转化率降低。
②根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=![]() 0.042mol·L-1·min-1;计算该反应的平衡常数K=
0.042mol·L-1·min-1;计算该反应的平衡常数K=![]() 4.0。
4.0。
③若30min后只改变某一条件,由上表中的数据可知,反应混合物中各组分的浓度均变为原来的1.5倍,加入合适的催化剂、加入一定量的活性炭都不可能达到这种情况;适当缩小容器的体积使各组分的浓度变为原来的1.5倍;再通入1mol NO可以增大NO的浓度,并且使平衡向正反应方向移动,当其达到平衡后可以达到这种情况,所以改变的条件可能是BC。
(2)该二甲醚氧气电池(电解质为KOH溶液)的总反应为CH3OCH3+3O2-+4OH- =2CO32- + 5H2O,正极的电极反应式为3O2+12e- + 6H2O=12OH-,负极反应式为CH3OCH3 — 12e- + 16OH- = 2CO32- + 11H2O。
(3)若某次捕捉后得到pH=10的溶液,则c(H+)=10-10mol/L,由K2(H2CO3)=![]() 5×10-11,可以求出c(CO32-)∶c(HCO3-)=
5×10-11,可以求出c(CO32-)∶c(HCO3-)=![]() 1:2(或0.5)。
1:2(或0.5)。


科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2+11O2=4B2O3 +2V2O5。下列说法不正确的是
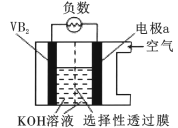
A. 电极a 为电池正极
B. 图中选择性透过膜为阴离子透过性膜
C. 电池工作过程中,电极a附近区域pH减小
D. VB2极发生的电极反应为:2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1) 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为___________________
(2)漂白粉的有效成分是(填化学式)_______________________ 。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式 _______________________________
(4)实验室制氯气的化学方程式为____________________________,如果想收集到纯净干燥的Cl2,应将该混合气体依次通入盛有_____和________ 的洗气瓶中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W ![]() X + H2O + CO2↑
X + H2O + CO2↑
②Z +CO2 → X + O2
③Z+H2O → Y + O2↑
④X + Ca(OH)2 → Y + CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:W________,X________,Y________,Z________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:_____________________________________________________。
②化学方程式:______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示,下列说法正确的是
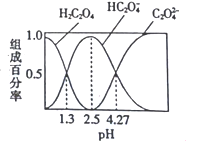
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反应HC2O4-+H2O![]() H2C2O4+OH-的平衡常数为10-4.27
H2C2O4+OH-的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质相互混合反应后,最终无白色沉淀生成的是
A. 过量Ba(OH)2溶液加入明矾溶液中 B. 过氧化钠投入FeCl2溶液中
C. 向NaAlO2溶液中通入过量CO2 D. 向饱和Na2CO3溶液中通入过量CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com