
【题目】氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物)做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____,基态原子核外未成对电子数较多的是_______。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N原子的杂化形式为____。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____。原因是____。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______。
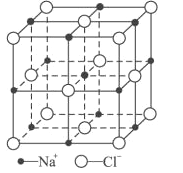
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
 。
。
【答案】 1s22s22p63s23p63d64s2 N Fe 直线形 sp3 NH3﹥AsH3﹥PH3 NH3之间形成了氢键,分子间作用力大,所以沸点高,AsH3和PH3结构相似,而AsH3的相对分子质量更大,故其分子间作用力比PH3大,所以AsH3的沸点比PH3更高 离子键、配位键、共价键或(离子键、配位键、σ键、π键) ![]()
【解析】(1)铁的原子序数为26,根据能量最低原理其态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2;元素Fe和N中,N的其态原子的电子排布式为1s22s22p3,最外层电子受到核的吸引力大于铁,第一电离能较大的是N,根据二者的电子排布可知,基态原子核外未成对电子数分别为4和3,较多的是铁,故答案为:1s22s22p63s23p63d64s2;N;Fe;
(2)N2O与CO2互为等电子体,结构相似,因此N2O的空间构型为直线形,故答案为:直线形;
(3)N2H4中N原子与3个原子相连,含有1个孤电子对,价层电子对数=3+1=4,采用sp3杂化,故答案为:sp3;
(4)NH3分子间能够形成氢键,沸点最高,AsH3和PH3结构相似,而AsH3的相对分子质量更大,故其分子间作用力比PH3大,所以AsH3的沸点比PH3更高,PH3、AsH3三种物质的沸点由高到低的顺序为NH3﹥AsH3﹥PH3,故答案为:NH3﹥AsH3﹥PH3;NH3之间形成了氢键,分子间作用力大,所以沸点高,AsH3和PH3结构相似,而AsH3的相对分子质量更大,故其分子间作用力比PH3大,所以AsH3的沸点比PH3更高;
(5)K3[Fe(CN)6]中存在离子键、极性共价键、配位键,故答案为:离子键、共价键、配位键;
(6)FeO晶体的晶胞与NaCl的相似,在FeO晶体的晶胞中含有Fe原子或O原子的数目均为4,某氧化亚铁晶体的实际组成为Fe0.9O,则1个晶胞的质量=![]() g,因此该晶体的密度=
g,因此该晶体的密度=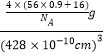 =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. FeSO4酸性溶液中加H2O2溶液:Fe2++H2O2+2H+==Fe3++2H2O
B. 明矾溶液中加过量氢氧化钡溶液:Ba2++SO![]() == BaSO4↓
== BaSO4↓
C. 亚硫酸氢钠溶液中加氢氧化钠溶液:HSO![]() +OH-== SO
+OH-== SO![]() +H2O
+H2O
D. 稀硝酸加入碳酸银中有气泡产生:CO![]() +2H+==CO2↑+H2O
+2H+==CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如下图所示。反应中镁和铝的( )

A. 物质的量之比为3∶2 B. 质量之比为3∶2
C. 摩尔质量之比为2∶3 D. 失去的电子数之比为8∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用 0.100 mol·L-1 的 NaOH 溶液滴定 10.00 mL 浓度均为 0.100 mol·L-1 的盐酸和 CH3COOH 溶液。利用传感器测得滴定过程中溶液的电导 率如图所示。下列说法正确的是( )

A. 曲线①代表滴定 HCl 溶液的曲线
B. A 点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同温度下,A、B、C 三点溶液中水的电离程度:C<B=A
D. D 点溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是( )
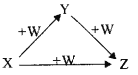
①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ①②③④⑤ B. ②④ C. ①③⑤ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgN03溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgI>AgCl>Ag2S D. AgCl>AgI>Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.人类能够有效利用氮气的主要途径是合成氨,生产化学肥料等。
完成下列填空:
(1)氮原子核外电子排布式为__________,其最外层有_______种运动状态不同的电子;氮气的电子式为______________;氨气分子的空间构型是______________。
(2)工业上常用醋酸亚铜氨溶液来吸收含有大量N2的高炉气体系中的CO,从而实现CO和N2的分离,反应的化学方程式如下:CH3COOCu(NH3)2 (aq) + CO(g)![]() CH3COOCu(NH3)2·CO(aq) + Q(Q>0),该反应的化学平衡常数表达式K=________;欲使K值变大,可采取的措施是_______。
CH3COOCu(NH3)2·CO(aq) + Q(Q>0),该反应的化学平衡常数表达式K=________;欲使K值变大,可采取的措施是_______。
吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的适当处理措施有
_____________(选填序号)。
a.适当升高温度 b.适当降低温度 c.增大压强 d.减小压强
(3)消除NH3对水体污染的重要方法是在一定条件下向水体中加入适量NaOH,这样能使NH3的脱除率增大,试用平衡移动原理解释其原因______________________________。
II.为实现CO2减排,合成氨工厂采用苯菲尔法脱碳。该方法是用碳酸钾溶液为吸收剂捕集混合气中的CO2得到富液,再高温加热富液使之分解释放出CO2 ,正常情况下再生的二氧化碳气体体积分数可达98.5%以上。
(4)某研究小组用200mL 1.5mol/L K2CO3溶液吸收了3.36L 的CO2(标准状况)形成富液,碳酸钾溶液吸收CO2的离子反应方程式为______________________________,该富液中的溶质是____________(填化学式),各离子的浓度关系正确的是_________。
a.c(K+) + c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
b.3c(K+)=4 c(CO32-)+4 c(HCO3-)+4c(H2CO3)
c.c(K+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com