
【题目】工业上冶炼钼的化学原理为:
①2MoS2+7O2![]() 2MoO3+4SO2
2MoO3+4SO2
②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl
④H2MoO4![]() MoO3+H2O
MoO3+H2O
⑤用还原剂将MoO3还原成金属钼。则下列说法中正确的是
A.MoS2煅烧产生的尾气可以直接排到空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
【答案】D
【解析】
A. 从反应①看,MoS2煅烧后的产物中有SO2,它是大气污染物,因此尾气不能直接排入空气中,故A错误;
B. 所谓碱性氧化性,是跟酸反应生成盐和水的氧化物,但从反应②可看出,MoO3和碱反应生成盐和水,因此MoO3应该是酸性氧化物,又从反应③看,MoO3是H2MoO4的酸酐,因此不可能是碱性氧化物,故B错误;
C. 由③可知,强酸制弱酸,所以H2MoO4的酸性比盐酸弱,无法确定是不是弱酸,故C错误;
D. 因为MoO3中钼元素显+6价,1molMoO3能得到6mol电子,而1molH2、CO、Al分别失去的电子数为2mol、2mol、3mol,根据电子守恒规律可知所消耗还原剂的物质的量之比为3:3:2,故D正确;
答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.工业制硫酸的反应中,若通入128 g SO2,生成SO3的分子数目为2NA
B.2 mol Na2S分子中含有S原子的数目为2NA
C.标准状况下,6.72 L NH3溶于水后,溶液中NH3·H2O和![]() 数目之和为0.3NA
数目之和为0.3NA
D.Zn与浓硫酸充分反应后,收集到气体0.5 mol,电子转移的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 四种物质间的转化关系如图所示 ,下列转化不能一步实现的是( )
序号 | X | Y | Z | W | 转化关系 |
A | FeCl3 | FeCl2 | Fe(OH)2 | Fe(OH)3 |
|
B | Na | NaOH | Na2CO3 | NaCl | |
C | Cl2 | Ca(ClO)2 | HClO | HCl | |
D | H2S | S | SO3 | H2SO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁与水蒸气反应,通常有以下两种装置,请思考以下问题:
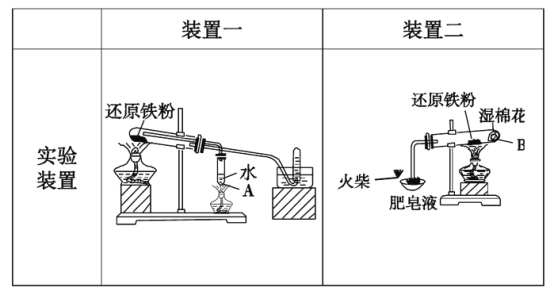
(1)方法一中,装置A的作用________________________。方法二中,装湿棉花的作用_______________________________________。
(2)实验完毕后,取出装置一的少量固体,溶于足量稀盐酸,再滴加KSCN溶液,溶液颜色无明显变化,试解释原因:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将SO2通入2L0.01mol·L-1的某一元碱MOH溶液中,溶液中水电离出的OH-的浓度(c)与通入的SO2的体积(V)关系如图所示(不考虑+4价的S被氧化),下列叙述不正确的是
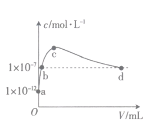
A.MOH为一元强碱
B.b点溶液中:c(H+)=1×10-7mol·L-1
C.c点溶液中:c(M+)=2[c(SO32-))+c(HSO3-)+c(H2SO3)]
D.d点溶液中:c(M+)=2c(SO32-)+c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E原子序数依次增大。A元素原子半径小于B,元素A、 E同主族。B是组成有机物的必要元素,C元素最高价氧化物对应水化物X与其氢化物Y反应生成一种盐。D元素的原子最外层电子数是其电子层数的3倍。
(1) E元素在周期表中的位置是__________; X和Y形成的化合物的化学式为___________;
(2)A、D两元素形成的原子个数比为1: 1的化合物的电子式为____________;
(3) Y的水溶液与氯化镁溶液反应的离子方程式为______________;
(4)元素B的单质能在加热条件下与浓硫酸反应,产物中含有两种气体物质,该反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中属于加成反应的是
A.CH4+2O2![]() CO2+2H2O
CO2+2H2O
B.CH2=CH2+Br2―→CH2Br—CH2Br
C.CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
D.CH3CH2CH2CH3![]() CH2= CH2+CH3—CH3
CH2= CH2+CH3—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生N2O4(g)2NO2(g),若反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20s,那么由0.06molL﹣1降到0.036molL﹣1,所需反应时间为( )
A. 10 sB. 12 sC. 大于12 sD. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C是一种水溶性维生素(其水溶液呈酸性),结构如图所示。人体缺乏维生素C易得坏血症,所以维生素C又称抗坏血酸。下列关于维生素C的叙述正确的是
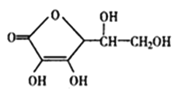
A.维生素C化学式为C6H7O6
B.维生素C能与溴水或酸性高锰酸钾发生加成反应而使其褪色
C.维生素C分子中含有羧基
D.维生素C可发生酯化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com