
����Ŀ����1����ѧ��Ӧ2A(g)+B(?)![]() 2C(g)�ﵽ��ѧƽ��ʱ��
2C(g)�ﵽ��ѧƽ��ʱ��
�������¶�ʱ��C�������٣���Ӧ��������ܺ�____________������������ܺͣ�����>������<������=������
���������ѹǿ��ƽ��������Ӧ�����ƶ�����B��____________̬���ʡ�
��������B�����ʵ�����ƽ�ⲻ�ƶ���˵��B��____________̬���ʡ�
��2����ͼ���ں�ѹ�ܱ������м���2 mol A��2 mol B����ʼʱ�������ΪV L���������·�Ӧ���ﵽ��ѧƽ��״̬��2 A(g)��B(g)![]() x C(g)��ƽ��ʱ��A��B��C�����ʵ���֮��Ϊ1��3��4��C�����ʵ���Ϊ y mol��
x C(g)��ƽ��ʱ��A��B��C�����ʵ���֮��Ϊ1��3��4��C�����ʵ���Ϊ y mol��
 �����������ݼ��㣬x ��_________��y ��_________��
�����������ݼ��㣬x ��_________��y ��_________��
���𰸡��� �� �̻�Һ 2 1.6
��������
��1���������¶�ʱ��C�������٣�˵������ƽ���������ƶ���˵���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����Է�Ӧ��������ܺʹ���������������ܺͣ������
���������ѹǿ��ƽ��������Ӧ�����ƶ���˵���÷�Ӧ���������ʵ���֮�ͼ�С�ķ�Ӧ������B�����壬�ʴ�Ϊ������
��������B�����ʵ�����ƽ�ⲻ�ƶ�����˵��B�ǹ̻�Һ̬���ʣ�
��2����ʼʱ�ں�ѹ�ܱ������м���2 mol A��2 mol B���������·�Ӧ2 A(g)��B(g)![]() x C(g)��ƽ��ʱ��A��B��C�����ʵ���֮��Ϊ1��3��4��C�����ʵ���Ϊ y mol����仯��B�����ʵ���Ϊb����仯��A�����ʵ���Ϊ2b���仯��C�����ʵ���Ϊxb����������ʽ��
x C(g)��ƽ��ʱ��A��B��C�����ʵ���֮��Ϊ1��3��4��C�����ʵ���Ϊ y mol����仯��B�����ʵ���Ϊb����仯��A�����ʵ���Ϊ2b���仯��C�����ʵ���Ϊxb����������ʽ��
2A(g)+B(g)![]() 2C(g)
2C(g)
��ʼ��mol�� 2 2 0
�仯��mol�� 2b b xb
ƽ�⣨mol�� 2-2b 2-b xb
xb=y��(2-2b):(2-b):xb=1:3:4�����b=0.8��x=2��y=1.6���ʴ�Ϊ��2��1.6��


 ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.��������ˮ��Cl2��H2O=2H����Cl-��ClO-
B.FeSO4��Һ�백ˮ��Ӧ�����ӷ���ʽ��Fe2����2NH3��H2O=Fe(OH)2����2NH4+
C.������Һ��KIO3��KI��Ӧ����I2��IO3-��I-��6H��=I2��3H2O
D.NaHCO3��Һ�м�����Ba(OH)2��Һ��2HCO3-��Ba2����2OH-=BaCO3����2H2O��CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����ںϳ�����������ҩ������ʣ���ṹ��ͼ��ʾ������X��Y��Z��Q��WΪ1~20��Ԫ����ԭ��������������Z��Qͬ���壬Q��W�ļ����Ӿ�����ͬ�ĵ��Ӳ�ṹ������������ȷ����
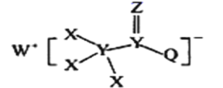
A.WX�ǹ��ۻ�����
B.����������Ӧ��ˮ��������ԣ�Q<Y
C.ԭ�Ӱ뾶��W>Z>Y
D.Z��X��Y��W��Q���γ��������ֶ�Ԫ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KMnO4����������Һ����Ӧ����ʽ��2KMnO4+16HCl===2KCl+2MnCl2+5Cl2��+8H2O����������Cl2�ڱ�״�������Ϊ56 L�����㣺
(1)�μӷ�Ӧ��HCl�����ʵ���________________
(2)��Ӧ�б�������HCl�����ʵ���__________________
(3)����˫���ű������ת�Ƶķ������Ŀ___________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ�Ĺ�ҵƷ����������ȡ±���������������ϵȡ��ش��������⣺
(1)��ϩ��HCl�ӳ�����CH3CHClCH3��CH3CH2CH2Cl�������뷴Ӧ������ͼ��
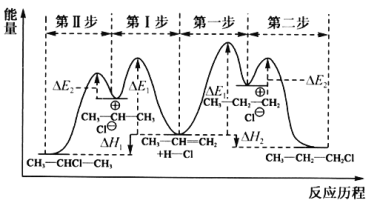
���������Ƕȿ������ȶ��IJ�����________(����CH3CHClCH3������CH3CH2CH2Cl��)��
����ȡCH3CHClCH3ʱ����Ӧ���ʽ����IJ�����________(������������)��
(2)����ֱ�������Ʊ�ϩ������Ȼ�ѧ��Ӧ���£�
����Ӧ��C3H8(g)��C3H6(g)+H2 ��H1=+124.27kJ��mol-1
����Ӧ��C3H8(g)��CH4(g)+C2H4(g) ��H2=+81.30kJ��mol-1
C3H8(g)+H2(g)��CH4(g)+C2H6(g) ��H3=-55.64kJ��mol-1
C2H4(g)+H2(g)��C2H6(g) ��H4
�٦�H4=_____________kJ��mol-1
���ֱ���0.1Mpa��0.01Mpaʱ������ͱ�ϩ��ƽ�����ʵ���������ͼ��ʾ��
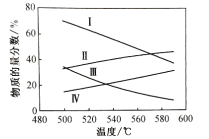
��ʾ0.1Mpaʱ�������ʵ�����������________(���������֣���ͬ)����ʾ0.01Mpaʱ��ϩ�������ķ�������________��
(3)�ö�����̼���������Ʊ�ϩ��Ҫ��Ӧ���£�
����C3H8(g)![]() C3H6(g)+ H2 ��H1>0ƽ�ⳣ��K1
C3H6(g)+ H2 ��H1>0ƽ�ⳣ��K1
����CO2(g)+H2(g)![]() CO(g)+H2O(g)����H2>0ƽ�ⳣ��K2
CO(g)+H2O(g)����H2>0ƽ�ⳣ��K2
������Ϸ�ӦC3H8(g)+CO2(g)![]() C3H6(g)+CO(g)+H2O(g)
C3H6(g)+CO(g)+H2O(g)
��C3H8�����ʵ���һ��ʱ������ͬͶ�ϱ�Z[Z=![]() ]���ܱ������г���C3H8��CO2��������Ӧ����C3H8ƽ��ת�������¶ȱ仯��ͼ��ʾ��
]���ܱ������г���C3H8��CO2��������Ӧ����C3H8ƽ��ת�������¶ȱ仯��ͼ��ʾ��
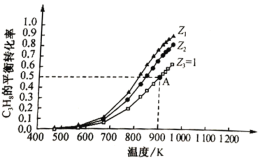
����Ӧ����ƽ�ⳣ��K=________(��K1��K2��ʾ)��
��Z1________(����>����<����=��)Z2��ԭ����________
����A��������ѹǿΪ0.2Mpa�����ϩ��ƽ���ѹΪ________MPa��900Kʱ��Ӧ����ƽ�ⳣ��Kp=________MPa(KpΪ��ƽ���ѹ��ʾ��ƽ�ⳣ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L���ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g��![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 600 | 800 | 830 | 1000 | 1200 |
K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK �� ��
��2���÷�ӦΪ ��Ӧ��ѡ��������������������������Ӧ��ƽ�������ͨ��һ����CO2����ƽ�ⳣ��K��________��CO2��ת����________��(����������������С������������)
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬�������� ����ѡ�۷֣���
a��������ѹǿ���� b�����������c(CO)���� c��v��(H2)��v��(H2O) d��c(CO2)��c(CO)
��4���� 600��ʱ���������г���1mol CO��1mol H2O����Ӧ�ﵽƽ���CO��ת������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����(����)
A.MnO2��Ũ�����ϼ��ȣ�MnO2��4H+��4Cl-![]() MnCl2�� Cl2����2H2O
MnCl2�� Cl2����2H2O
B.����������Һ�м�������泥�Ba2+��OH-��![]() ��
��![]() ===BaSO4����NH3��H2O
===BaSO4����NH3��H2O
C.FeSO4��Һ�м��������ữ��H2O2��Fe2����H2O2��2H+===Fe3+��2H2O
D.0.01 mol��L-1 NH4Al(SO4)2��Һ��0.02 mol��L-1 Ba(OH)2��Һ�������ϣ�![]() ��Al3+��2
��Al3+��2![]() ��2Ba2+��4OH-===2BaSO4����Al(OH)3����NH3��H2O
��2Ba2+��4OH-===2BaSO4����Al(OH)3����NH3��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�����A2(g)��3B2(g)![]() 2AB3(g)��Ӧ��˵�����»�ѧ��Ӧ���ʵı�ʾ�У���ѧ��Ӧ����������
2AB3(g)��Ӧ��˵�����»�ѧ��Ӧ���ʵı�ʾ�У���ѧ��Ӧ����������
A. v(A2)��0.8 mol��L��1��s��1 B. v(A2)��30 mol��L��1��min��1
C. v(AB3)��1.0 mol��L��1��s��1 D. v(B2)��1.2 mol��L��1��s��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȵĹ��嵥��M����Ũ�����У����ҷ�Ӧ�������������A��A�ڳ����²�������Ӵ�ʱ��������ͼ��ʾ�ı仯��

(1)�������A����Ҫ�ɷ���____________��
(2)����BΪ__________����ɫ��ҺDΪ____________��
(3)����M��Ũ���ᷴӦ�Ļ�ѧ����ʽ��____________________________��
(4)����C��ϡ���ᷴӦ�Ļ�ѧ����ʽ��________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com