
【题目】碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=—1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H= —566kJ/mol
则表示甲烷燃烧热的热化学方程式_______________________。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
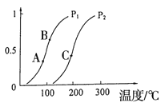
①一定条件下CH4的平衡转化率与温度、压强的关系如图,则Pl_______P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为___________(填“<”、“>”“=”)。
②100℃时,将1mol CH4和2mol H2O通入容积为10L的反应室,反应达平衡的标志是:_______。
a.容器的压强恒定
b.单位时间内消耗0.1mol CH4同时生成0.3mol H2
c.容器内气体密度恒定
d.3v(CH4)=v(H2)
e. 容器内气体平均相对分子质量恒定
(3)已知2H2(g)+CO(g)![]() CH3OH(g)△H=-akJmol-1(a>0),在一个容积固定的容器中加入2mol H2和1mol CO,在500℃时充分反应,达平衡后CH3OH的浓度为W molL-1。反应平衡后,若向原来容器中再加入2mol H2和1mol CO,500℃充分反应再次达平衡后,则CH3OH浓度___________2WmolL-1(填“>”、“<”或“=”)。
CH3OH(g)△H=-akJmol-1(a>0),在一个容积固定的容器中加入2mol H2和1mol CO,在500℃时充分反应,达平衡后CH3OH的浓度为W molL-1。反应平衡后,若向原来容器中再加入2mol H2和1mol CO,500℃充分反应再次达平衡后,则CH3OH浓度___________2WmolL-1(填“>”、“<”或“=”)。
(4)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图所示的电池装置,
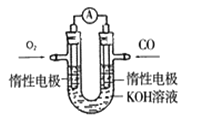
①负极的电极反应式为___________。
②用该原电池做电源,用惰性电极电解200mL饱和食盐水(足量),消耗标准状况下的CO 224mL,则溶液的pH=___________。
【答案】CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1 < KC>KB>KA ae > CO-2e-+4OH-=CO32-+2H2O 13
【解析】
(1)根据已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=—1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H= —566kJ/mol
依据盖斯定律①+② 2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) △H=-1780kJ·mol-1,则表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1;
(2)①在相同温度下CH4的转化率在P1时比P2的高,根据反应方程式CH4(g)+H2O(g)![]() CO(g)+3H2(g)可知,增大压强,平衡逆向移动,CH4的转化率降低,所以温度一定时P1<P2;平衡常数只受温度影响,压强不变升高温度,甲烷的转化率会增大,平衡正向进行,所以反应是吸热反应,所以温度越高,K越大,A、B、C三点处对应的温度是逐渐升高的,所以平衡常数KC>KB>KA;
CO(g)+3H2(g)可知,增大压强,平衡逆向移动,CH4的转化率降低,所以温度一定时P1<P2;平衡常数只受温度影响,压强不变升高温度,甲烷的转化率会增大,平衡正向进行,所以反应是吸热反应,所以温度越高,K越大,A、B、C三点处对应的温度是逐渐升高的,所以平衡常数KC>KB>KA;
②a. CH4(g)+H2O(g)![]() CO(g)+3H2(g)可知,该反应为气体体积增大的反应,压强为变量,当容器的压强恒定,说明正逆反应速率相等,达到平衡状态,故a正确;
CO(g)+3H2(g)可知,该反应为气体体积增大的反应,压强为变量,当容器的压强恒定,说明正逆反应速率相等,达到平衡状态,故a正确;
b.单位时间内消耗0.1molCH4同时生成0.3molH2,只能说明正反应速率,不能证明正逆反应速率相等,不一定平衡,故b错误;
c.容器内气体密度p=![]() ,质量是守恒的,V是不变的,所以密度始终不变,当密度不变时,不一定平衡,故c错误;
,质量是守恒的,V是不变的,所以密度始终不变,当密度不变时,不一定平衡,故c错误;
d.3v(CH4)=c(H2),没有指出正逆反应速率,无法判断是否达到平衡状态,故d错误;
e.该反应前后都是气体,且气体总物质的量为变量,则混合气体的平均摩尔质量为变量,当容器内气体平均相对分子质量恒定时,表明达到平衡状态,故e正确;
故答案为:ae;
(3)已知2H2(g)+CO(g)![]() CH3OH(g)△H=-akJmol-1(a>0)在一个容积固定的容器中加入2molH2和1molCO,在500℃时充分反应,达平衡后CH3OH的浓度为W mol·L-1,反应平衡后,若向原来容器中再加入2molH2和1molCO,假如平衡不移动,则平衡时CH3OH浓度为2W mol·L-1,由于增大了压强,平衡向着正向移动,甲醇浓度增大,则再次达平衡后,则CH3OH浓度大于2W mol·L-1,所以答案:>;
CH3OH(g)△H=-akJmol-1(a>0)在一个容积固定的容器中加入2molH2和1molCO,在500℃时充分反应,达平衡后CH3OH的浓度为W mol·L-1,反应平衡后,若向原来容器中再加入2molH2和1molCO,假如平衡不移动,则平衡时CH3OH浓度为2W mol·L-1,由于增大了压强,平衡向着正向移动,甲醇浓度增大,则再次达平衡后,则CH3OH浓度大于2W mol·L-1,所以答案:>;
(4)由图可知为CO的燃料电池,电解质溶液为KOH(aq),负极CO发生氧化反应,失电子和氢氧根离子反应生成碳酸根离子和水,负极反应式为CO-2e-+4OH-=CO32-+2H2O;
②消耗标准状况下的CO的体积为224mL,则CO的物质的量为n=0.224L÷22.4L/mol=0.01mol,根据负极反应式CO-2e-+4OH-=CO32-+2H2O知,转移电子为0.02mol,电解饱和食盐水的离子方程式为2Cl-+2H2O![]() H2↑+Cl2↑+2OH-,由电子守恒可知,生成的氢氧根离子的物质的量为0.02mol,则c(OH-)=0.1mol/L,pH=13。
H2↑+Cl2↑+2OH-,由电子守恒可知,生成的氢氧根离子的物质的量为0.02mol,则c(OH-)=0.1mol/L,pH=13。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】室温下,下来事实不能说明NH3·H2O为弱电解质的是
A. 0.1 mol·L-1NH3·H2O的pH小于13
B. 0.1 mol·L-1 NH4Cl溶液的pH小于7
C. 相同条件下,浓度均为0.1 mol·L-1 NaOH溶液和氨水,氨水的导电能力弱
D. 0.1 mol·L-1NH3·H2O能使无色酚酞试液变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1;
CH3OH(g)+H2O(g) △H1;
②CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | X |
回答下列问题:
(1)已知△H2=-99 kJ·mol-1,则根据上表相关的化学键键能(“C![]() O”表示CO的化学键)计算X=_______ kJ·mol-1。
O”表示CO的化学键)计算X=_______ kJ·mol-1。
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系式为___________。
(3)根据化学反应原理,分析增大压强对反应③的影响为_______________。(提示:从对反应速率、平衡状态、转化率角度回答)
Ⅱ.清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)△H=-99kJmol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)△H=-99kJmol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是_________;
②反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=_____;
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=_________;
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼对植物的生长和人体骨骼的健康有着十分重要的作用。请回答下列问題:
(1)区分晶体硼和无定硼形科学的方法为_________________________________。
(2)下列B原子基态的价层电子排布图中正确的是___________
A.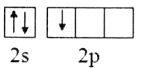 B.
B.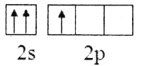
C.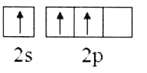 D.
D.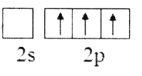
(3)NaBH4是重要的储氢载体,阴离子的立体构型为___________。
(4)三硫化四磷分子(结构如下图1所示)是___________分子(填极性”或非极性)。
(5)图2表示多硼酸根离子的一种无限长的链式结构,其化学式可表示为___________。
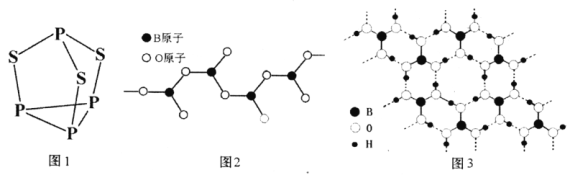
(6)硼酸晶体是片层结构,其中一层的结构如图3所示。硼酸在冷水中溶解度很小,但在热水中较大,原因是_________________________________。
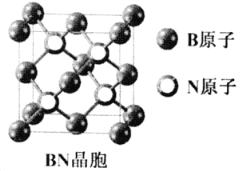
(7)立方氮化硼(BN)是新型高强度耐磨材料,可作为金属表面的保护层,其晶胞结构(如右图)与金刚石类似。已知该晶体密度为ag/cm3,则晶体中两个N原子间的最小距离为___________pm。(用含a的代数式表示,NA表示阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含有的Cr2O72-和CrO42-会对水体产生很大的危害,因此这种工业废水必须净化处理。一种处理含铬废水的工艺流程如下:
CrO42—![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
①中反应为2 CrO42-(黄色)+2H+Cr2O72-(橙色)+H2O。
下列说法正确的是
A.①中,酸化后废水黄色变浅
B.②中,反应的氧化剂与还原剂的物质的量之比为3︰1
C.③中,所得沉淀Cr(OH)3中含有Fe(OH)3
D.①中,所加酸可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A.v (N2)=0.2molL﹣1min﹣1B.v (N2)=5molL﹣1s﹣1
C.v (NH3)=0.1molL﹣1min﹣1D.v (H2)=0.3molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于可逆反应的是( )
①N2+3H2![]() 2NH3,2NH3
2NH3,2NH3![]() 3H2+N2
3H2+N2
②2NaHCO3![]() Na2CO3+H2O↑+CO2↑,Na2CO3+H2O+CO2===2NaHCO3
Na2CO3+H2O↑+CO2↑,Na2CO3+H2O+CO2===2NaHCO3
③CH3CH2OH![]() CH2===CH2↑+H2O,CH2===CH2+H—OH
CH2===CH2↑+H2O,CH2===CH2+H—OH![]() CH3CH2OH
CH3CH2OH
④2Na+Cl2![]() 2NaCl, 2NaCl
2NaCl, 2NaCl![]() 2Na+Cl2
2Na+Cl2
A.只有①B.①②③
C.①②③④D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com