
����Ŀ����Ƶ���ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش���������:
��1����̬Caԭ����,�������ռ������ܲ�ķ�����________�����ܲ�Ϊ�����ʱ���������ɵĵ�����Ϊ_________��Ԫ��Ca��S���,��һ�����ܽϴ����______(��Ԫ�ط���)��
��2����Ԫ�ص���ɫ��Ӧ��ש��ɫ,���к�ɫ��Ӧ�ķ������Ԫ�ص���ɫ��Ӧ��Ӧ��ɫ�ķ��䲨��,�϶̵���_______(��Ԫ�ط���)��
��3��H2S��H2O���ӹ��Ͷ�ΪV��,����ԭ�ӵ��ӻ���ʽ����______,��H2O���Ӽ��Ǵ���H2S����,ԭ����________________��
��4����Ԫ�غ���Ԫ������ͬһ���ڣ��Һ����������ӹ�����ͬ,�������Ƶ��۵㡢�е�ȶ��Ƚ����̵�,ԭ����________________��
��5��Ca��Mn��Mg������������ﶼ����NaCl�ͽṹ�����Ӿ��������������Ӳ��������������ܶѻ���ʽ,X��������ʵ�������ǵľ����������±�:
�����ᄃ�� | CaO | MnO | MgO |
a/nm | 0.421 | 0.444 | 0.480 |
���ᄃ�� | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
�ɱ���֪:r(S2-)____r(O2-)(����>������<��),r(Mg2+)��r(Ca2+)��r(Mn2+)�ɴ�С�ĵ�˳����__________,r(S2-)Ϊ_____nm,r(Ca2+)Ϊ_____nm��
���𰸡� N 18 S K sp3�ӻ� OԪ�ص縺�Դ���SԪ�أ�������O-H�����ӶԵĵ����Ƹ�ƫ������Oԭ�ӣ�ʹ�������������� �Ƶ�ԭ�Ӱ뾶�ϴ��Ҽ۵��������٣����������� > r(Ca2+)>r(Mn2+)>r(Mg2+) 0.184 0.100
��������Ca��20��Ԫ�أ�������4�����Ӳ㣬�������ռ������ܲ�ķ�����N, ���ݺ�������Ų����ɣ�����㲻�ܳ���18�����ӣ���һ������S>Mg>Ca,��һ�����ܽϴ����S�ʴ𰸣� N 18 S��
��2����Ԫ�ص���ɫ��Ӧ��ש��ɫ,��Ԫ�ص���ɫ��Ӧ����ɫ����ɫ�ķ��䲨���Ⱥ�ɫ�̣��ʴ𰸣�K��
��3��H2S��H2O���ӹ��Ͷ�ΪV��,����ԭ�ӵ��ӻ������Ŀ����4��������SP3�ӻ���OԪ�صĵ縺�Դ���S,������O-H�����ӶԵĵ���������ԭ�ӣ�ʹ����������H2O���Ӽ��Ǵ���H2S���ӡ��𰸣�sp3�ӻ� OԪ�ص縺�Դ���SԪ�أ�������O-H�����ӶԵĵ����Ƹ�ƫ������Oԭ�ӣ�ʹ�������������� ��
��4���Ƶ�ԭ�Ӱ뾶�ϴ��Ҽ۵��������٣�������������ʹ�ý����Ƶ��۵㣬�е�ȶ��Ƚ����̵ͣ��ʸƵ�ԭ�Ӱ뾶�ϴ��Ҽ۵��������٣�������������
��5���ɱ���֪����ͬ�����ľ��������У�������Ķ�С������ģ����:r(S2-)>r(O2-),���ݲ�ͬ����������ľ�������r(Mg2+)��r(Ca2+)��r(Mn2+)�ɴ�С��˳����r(Ca2+)>r(Mn2+)>r(Mg2+)����ΪS2-��������������ܶѻ���ʽ����Խ�����S2-�뾶��4������4r=![]() 0.520 r=0.184 nm���������Ȼ��ƽṹ�����ݾ����Ľṹ����������=
0.520 r=0.184 nm���������Ȼ��ƽṹ�����ݾ����Ľṹ����������= ![]() ��Ca2+��=
��Ca2+��=![]() =0.100 nm �𰸣�r(Ca2+)>r(Mn2+)>r(Mg2+) 0.184 0.100
=0.100 nm �𰸣�r(Ca2+)>r(Mn2+)>r(Mg2+) 0.184 0.100


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С������ȡ����ͭ��֤������ͭ�ܼӿ�����صķֽ⣬����������ʵ�飺
��һ����ȡ����ͭ
�ٳ�ȡ2 gCuSO4��5H2O��ϸ�����ձ�����10 mL����ˮ�ܽ⣻
��������CuSO4��Һ����μ���NaOH��Һ��ֱ�����ٲ���������Ȼ�����û����ת�Ƶ���������������ȫ����Ϊ��ɫ��
�۽���������û������ˡ�ϴ�ӣ����ɺ���ϸ���á�
�ش��������⣺
��1������١�������ĥ��������������������__________________��
��2���������ϴ�ӳ����IJ�����____________________________________��
������֤������ͭ�ܼӿ�����صķֽⲢ��������̵Ĵ�Ч�����бȽ���ͼװ�ý���ʵ�飬ʵ��ʱ��������25 mL����Ϊ����������Ӱ��ʵ������ؾ��Ѻ��ԣ�������ݼ��±���

ʵ����� | KClO3���� | ������������ | �������� |
�� | 1.2g | ���������� | |
�� | 1.2g | CuO 0.5g | |
�� | 1.2g | MnO2 0.5g |
�ش��������⣺
��3������ʵ���еġ��������ݡ�ָ__________________��
��4����Ҫ֤��ʵ����и�������ռ���������O2���ɴ������ռ��������õ��ɼм�סB���齺�ܣ���ȥ������ϵ�����Ƥ����____________________________________��
��5��Ϊ̽��CuO��ʵ������Ƿ�������ã��貹������ʵ�飨����д�������������a��_________________________________��b��CuO�Ļ�ѧ������û�иı䡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������÷�Һ©����������� ��
A. ��ˮ B. �ƾ���ˮ C. ����������̼������Һ D. �����屽
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������з�Ӧ��ѧ����ʽ��
��1��������ϩ�ƾ�����ϩ��
��2��ʪ����ͭ��
��3����CO��ԭ������Fe2O3��ұ������
��4������������Al2O3��ұ������
��5�������ѽ�����ϩ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС�������ͼ��ʾװ�ý���ԭ���ԭ����̽������������������ǣ� ��

A. a��b�õ�������ʱ��������Zn����������Cu���پ�ϡ��������Zn
B. a��b�õ�������ʱͭƬΪ�����������ķ�ӦʽΪ��2H++2e-=H2��
C. a��b������ʱ��пƬ�����������ɣ���װ�ò����γ�ԭ���
D. ����a��b�Ƿ����ӣ�ϡ��������뷴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��3��21���ǵڶ�ʮ���������ˮ����������ˮ��Դ���������÷�ˮ��ʡˮ��Դ����ǿ��ˮ�Ļ��������ѱ�Խ��Խ���������ע����֪��ij��ɫ��ˮ�п��ܺ���H����NH4+��Fe3����Al3����Mg2����Na����NO3-��CO32-��SO42-�еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ100mL������������ʵ�飬��������й�ͼ��������ʾ��
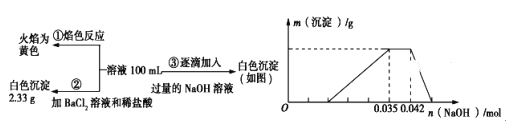
��ش��������⣺
��1����������3��ʵ����Է�����ˮ��һ�������ڵ���������__________��һ�����ڵ���������______________________��
��2��д��ʵ���ͼ���г����ﵽ��������������ٷ����仯�η�����Ӧ�����ӷ�Ӧ����ʽ��_____________________________________________��
��3������ͼ����ԭ��Һ��c(NH4+)��c(Al3��)�ı�ֵΪ___________�����ó��������������_________g��
��4����ͨ��ʵ��ȷ��ԭ��ˮ��c(Na��)=0.14 mol��L-1,���ж�ԭ��ˮ��NO3-�Ƿ���ڣ�__________����������������������������ȷ�������������ڣ�c(NO3-)=____________ mol��L-1�����������ڻ�ȷ����˿ղ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽����������Է�ӦaX��g��+bY��g��cZ��g����Ӱ�죬��X��Y���ʵ�����Ϊa��b��ʼ��Ӧ��ͨ��ʵ��õ���ͬ�����´ﵽƽ��ʱZ�����ʵ���������ʵ������ͼ��ʾ�������ж���ȷ���ǣ������� 
A.��H��0��a+b��c
B.��H��0��a+b��c
C.��H��0��a+b��c
D.��H��0��a+b��c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ���ִ���ᷢչ����Ҫ֧�����������ڶ�����Դ����
A.̫����B.ˮ��C.��ϫ��D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����ͨѶ����ͨ���ճ����������Ź㷺��Ӧ�ã�
��1���������˵����ȷ����������ţ���
A.ͨ��ij�ֵ�ص�λ������λ���������������Ķ��٣������жϸõ�ص�����
B.���ε���ֳƳ���ػ����أ������ؿ������ظ�ʹ��
C.�������⣬�״������͡������ȶ�������ȼ�ϵ�ص�ȼ��
D.���������ϵ�ر�����м��д��������ⱻ�ᵽ�����ճ̣�����Ҫԭ���ǵ����ǵĽ���������Ҫ����
��2��Ŀǰ���õ�����Ni���ӣ�Cd����أ������ܷ�Ӧ�ɱ�ʾΪ�� 2Ni��OH��2+Cd��OH��2 ![]() Cd+2NiO��OH��+2H2O
Cd+2NiO��OH��+2H2O
��֪Ni��OH��2 ��Cd��OH��2 ��������ˮ�����������ᣬ����˵����ȷ���� ��
A.��طŵ�ʱCd������
B.��Ӧ����Ϊ����
C.���Ϸ�Ӧ�ǿ��淴Ӧ
D.�õ����һ�ֶ��ε��
��3��������ɴ��������������Ͼ���ʹ�õ�����ȼ�ϵ����һ�����͵�Դ���乹����ͼ��ʾ��a��b�����缫���ɶ��̼����ɣ�ͨ��������������ɿ�϶�����룬���ڵ缫���淢����Ӧ���ŵ磮 ��a�缫�ǵ�Դ������
�����õ��Ϊ����Ա�ṩ��360kg��ˮ�����·��ͨ����mol���ӣ�
����֪H2��ȼ����Ϊ285.8kJmol��1 �� ���ȼ�ϵ�ع�������36gH2Oʱ��ʵ���ϲ�����468.8kJ�ĵ��ܣ����ȼ�ϵ�ص�����ת������ �� ��ȷ��0.01��������ת������ʵ�����ͷŵĵ��ܺ������Ϸ�Ӧ�ų������ܵı��ʣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com