
| A、①>②>③ |
| B、②>①>③ |
| C、③>①>② |
| D、②>③>① |
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
| A、纯碱(Na2CO3) |
| B、绿 矾( FeSO4?7H2O ) |
| C、硫磺(S) |
| D、碱石灰(Ca(OH)2 ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含金属元素的氧化物一定是碱性氧化物 |
| B、可以电离出氢离子的物质就属于酸 |
| C、物质的量是七个国际基本单位之一 |
| D、电解质的电离不需要通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
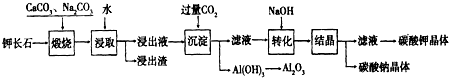
查看答案和解析>>
科目:高中化学 来源: 题型:
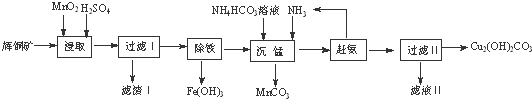
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气、SO2都具有氧化性,故而可用于漂白纸浆等 |
| B、常温下浓硫酸能与铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| C、H2CO3是弱酸,所以NaHCO3是弱电解质 |
| D、较强的酸可以制取较弱的酸,次氯酸溶液无法制取盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com