
����Ŀ���ڽӴ���������������У�SO2ת����SO3ת���ʵĴ�Сֱ�Ӿ�������Ч�ʡ�ij�о�С������ͼװ��ģ�����������вⶨSO2ת����SO3��ת���ʡ���֪SO3���۵���16.8�����е���44.8����װ���������漰��Ӧ�Ļ�ѧ����ʽΪ�� ��
��1�����е��Լ��� ��������������Ϊ ��װ����������Ӧ�Ļ�ѧ����ʽ�� ��
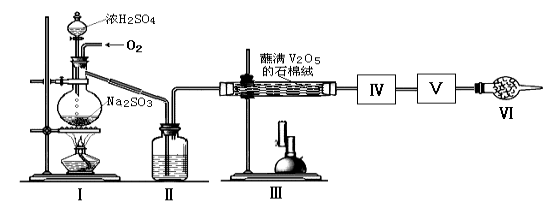
��2������ʵ����Ҫ��Ӧ���������������Ӻ��ʵ�װ�á������ͼA��Dװ����ѡ�����ʺ�װ�ò��������������Ŀո��У������������ӵ�װ�÷ֱ��� �� ��
��3��Ϊ�����SO2��ת���ʣ�ʵ��ʱ�ڣ����μ�Ũ��������ȴ����IJ����У�Ӧ��ȡ�IJ������Ⱥ�˳��_____________(����)��
��4��ʵ�������������ռ�SO3���Թܳ���¶���ڿ����У��ܹ������ܿ��д����İ����������������ԭ���� ��
��5����18.9gNa2SO3��ĩ��������Ũ��������д�ʵ�飬����Ӧ����ʱ������ͨ��O2һ��ʱ�����װ����������7.2g����ʵ����SO2��ת����Ϊ ��
���𰸡�Na2SO3+H2SO4=Na2SO4+SO2��+H2O
��1��Ũ���� ����� 2SO2+O2![]() 2SO3
2SO3
��2��C D ��3����
��4��SO3�ӷ�����������ˮ ��5��25%
��������
�������:��װ��Ϊʵ�����Ʊ����������װ�ã��������ƺ�Ũ������ȷ�Ӧ���ɶ�������Na2SO3+H2SO4=Na2SO4+SO2��+H2O����1�����е��Լ���Ũ���ᣬ���ն��������к��е�ˮ������������������Ϊ���θ���ܣ�װ����������ӦΪ�����������Ĵ�����������������2SO2+O2![]() 2SO3 ; ��2��SO3���۵���16.8�����е���44.8��,�ⶨSO2ת����SO3��ת���ʡ�A�ⶨ���ʣ��Ķ���������������ü�ʯ�������գ��漰����������ĸ������⣬����֮ǰ����SO3���۵���16.8���Ƚϵͣ��ñ�ˮ��ȴ������壬���������Ϊ���壬���ɴﵽĿ�ģ����ѡ���װ��Ϊ��C ��D�� ��3���÷�ӦΪһ�����ȵĿ��淴Ӧ�������Ĵ�Ч����Ҫһ�����¶ȣ���ˣ��ȸ�����Ԥ�ȣ�Ȼ����ͨ������������壬��ѡ����������4��SO3���������ˮ������Ӧ���������ᣬ�����������ȣ����������İ�������5��װ����������7.2g��Ϊʣ��Ķ�������������������ʵ���Ϊ9/80mol; ��Na2SO3+H2SO4=Na2SO4+SO2��+H2O�����Ķ����������������Ϊ18.9/126 =0.15 mol; ��Ӧ����n(SO2)= 18.9/126- 9/80=0.0375 mol ���Զ��������ת����Ϊ0.0375/0.15��100%=25%;
2SO3 ; ��2��SO3���۵���16.8�����е���44.8��,�ⶨSO2ת����SO3��ת���ʡ�A�ⶨ���ʣ��Ķ���������������ü�ʯ�������գ��漰����������ĸ������⣬����֮ǰ����SO3���۵���16.8���Ƚϵͣ��ñ�ˮ��ȴ������壬���������Ϊ���壬���ɴﵽĿ�ģ����ѡ���װ��Ϊ��C ��D�� ��3���÷�ӦΪһ�����ȵĿ��淴Ӧ�������Ĵ�Ч����Ҫһ�����¶ȣ���ˣ��ȸ�����Ԥ�ȣ�Ȼ����ͨ������������壬��ѡ����������4��SO3���������ˮ������Ӧ���������ᣬ�����������ȣ����������İ�������5��װ����������7.2g��Ϊʣ��Ķ�������������������ʵ���Ϊ9/80mol; ��Na2SO3+H2SO4=Na2SO4+SO2��+H2O�����Ķ����������������Ϊ18.9/126 =0.15 mol; ��Ӧ����n(SO2)= 18.9/126- 9/80=0.0375 mol ���Զ��������ת����Ϊ0.0375/0.15��100%=25%;
����:������Ʊ� �����ӡ��������衢ת���ʵļ��㡣


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�����
��1�������Ǵ�ͳ�Ľ��ա�����ص����ǻ�������ֽ�ͨ���ؼ���������Բ��
�� �����������ʿ���������ɻ���̥����Ҫ������ ������ĸ����
a�����Ͻ� b���� c������
�� ��·����Ҫ�Ľ�ͨ���ߡ�������·��Ҫ����ˮ�ࡣ��ҵ������ˮ�����Ҫԭ����ʯ��ʯ�� ������ĸ����
a����� b������ c��ʯӢ
�� �ִ�Ҳ����Ҫ�Ľ�ͨ���ߡ�Ϊ�����ְ岻�ܸ�ʴ���ڴ�β�ְ�����Ƕ�Ľ������� ������ĸ����
a��ͭ�� b��п�� c������
��2��������ڼ��ۻ�Ҫע����ʳ��������֤���彡����
��ƽʱҪ���ˮ��ˮ������������Ҫ���������ܡ����������������п���ˮ����� ������ĸ��
a�������� b�������� c����֬
������ѡ����ʳ������Ѽ���������dz���ʳ�ģ����Ǹ�����Ӫ����������֬�� ���������۵�������ٽ��ˣ����۵Ļ�ѧʽ�� ���߲˺�ˮ������ά����C�����������������ҽ��ά����CƬ����ҩƬ�����һ�����������������ó��˸��ƿڸ��⣬����Ҫ�������� ��
����֭�Ǽ���ij�����Ʒ��ijƷ�Ƴ�֭�к��а�ɰ�ǡ������Ρ����ʻƺͱ������ƣ��⼸��������������ɫ������ ��
����ʳ����������θʹ��θ��ƽ[��Ҫ�ɷ���Al��OH��3]������θ�������д��Al��OH��3��θ�ᷴӦ�����ӷ���ʽ ��
��3�������ڼ䣬������������������ʱҪ��������������������
����������Ǽ��ճ��е�������������ı�����Ϊ2015��Ƽ��ȴʡ��϶��ŷ��������岻����������ֵ��� ������ĸ����
a��N2 b�� NO2 c��CO2
���ù��ľ���ϩ����ʳƷ��ҪͶ�����пɻ������־���������С�����ϩ�Ľṹ��ʽ�� ��
��˽�ҳ����������δ������㣬�����¡���Ⱦ���ɻرܡ�����β���е�CO��NO2�������������¿�ת��Ϊ�������ų����仯ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100 mLNaOH��Һ��ͨ��һ������CO2���壬��ַ�Ӧ������������Һ����μ���2.0 mol/L�����ᣬ����CO2������������������֮���ϵ��ͼ��ʾ��
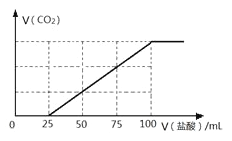
�ش��������⣺
��1��ԭNaOH��Һ�����ʵ���Ũ��Ϊ______ mol/L��
��2������ͨ��CO2��������Һ�����ʳɷ�Ϊ______�����������ڵ��µ�ѹ���������ɣ����ù������ʣ������ᾧˮ��������Ϊ_______ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ˮ�ĵ�����ʹ��Һ���ֳ����Ե���
A��Na2CO3 B��Al2��SO4��3 C��K2SO4 D��H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯����������������й㷺Ӧ�ã���ش��������⣺
��1��������FeS2�������������ұ����������Ҫԭ�ϣ�����һ����ӦΪ3FeS2+8O2![]() 6SO2+Fe3O4���÷�Ӧ����������Ϊ________������3mol FeS2�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ_______��
6SO2+Fe3O4���÷�Ӧ����������Ϊ________������3mol FeS2�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ_______��
��2��FeCl3������ᷴӦʱ��������ɫ���ʣ��÷�Ӧ�����ӷ���ʽΪ_________��
��3����һ������Fe2O3����160mL 5molL��1�����У��ټ���һ�������ۣ�����ǡ����ȫ�ܽ⣬�ռ�������2.24L����״����������⣬��ҹ����Fe3+����μӷ�Ӧ�����۵�����Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ��Ӧ����˵����ȷ����
A����ѧ��Ӧ������ָһ��ʱ�����κ�һ�ַ�Ӧ��Ũ�ȵļ�С���κ�һ��������Ũ�ȵ�����
B�����ݻ�ѧ��Ӧ���ʵĴ�С����֪����ѧ��Ӧ���еĿ���
C����ѧ��Ӧ����0.8 mol/(L��s)��ָ1 sʱij���ʵ�Ũ��Ϊ0.8 mol/L
D�������κλ�ѧ��Ӧ��˵����Ӧ����Խ��Ӧ�����Խ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ��2A��g��+B��g��2C��g������H��0�����и�ͼ��ȷ���ǣ���仯���������ʵľۼ�״̬û�з����ı䣩
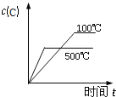
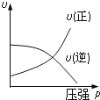
A B C D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ҩ���ҹ����Ĵ���֮һ���������˳��ޣ��䷴Ӧԭ��Ϊ��
S+3C+2KNO3![]() N2��+3CO2��+K2S
N2��+3CO2��+K2S
��ش�����������⣺
��1��������0.1molN2ʱ����Ӧ�й�ת�Ƶ�����Ϊ_____����ԭ�������ʵ���Ϊ_____mol��
��2�������ɱ�״����33.6LCO2����S������C�����ʵ�����_____mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com