
【题目】Ⅰ、在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图中表示NO2的变化的曲线是_____。用NO表示从0~2 s内该反应的平均速率υ=_______。
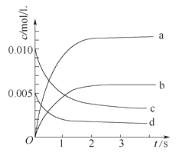
(2)能说明该反应已达到平衡状态的是_______。
a.υ(NO2)=2υ(O2) b.容器内压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内密度保持不变
(3)下列措施能使该反应的速率增大是_______。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
【答案】b 0.003mol/(L·s) bc bcd
【解析】
(1)根据表格知,随着反应的进行,NO的物质的量减小,则NO2的物质的量逐渐增大,根据NO和NO2之间转化关系式计算平衡时NO2的物质的量,从而确定曲线;根据υ=![]() 计算NO的反应速率;
计算NO的反应速率;
(2)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(3)根据外界条件对反应速率的影响进行分析解答。
(1)根据表格知,随着反应的进行,NO的物质的量减小,则NO2的物质的量逐渐增大,当反应达到平衡状态时,参加反应的n(NO)=(0.0200.007)mol=0.013mol,根据NO2和NO的关系式知,平衡状态时生成n(NO2)等于参加反应的n(NO),所以为0.013mol,c(NO2)=![]() =0.0065mol/L,则表示NO2的变化的曲线是b;0~2s时,υ (NO)=
=0.0065mol/L,则表示NO2的变化的曲线是b;0~2s时,υ (NO)= =0.003mol/(L·s);
=0.003mol/(L·s);
(2)a.当υ(NO2)=2υ(O2)时,没有指明反应速率的方向,不能判断反应是否达到平衡状态,故a不选;
b.该反应是一个反应气体气体体积改变的可逆反应,当达到平衡状态时,各物质的浓度不变,则容器内压强保持不变,即容器内压强保持不变能说明反应达到平衡状态,故b选;
c.υ逆(NO):υ正(O2)=2:1时,该反应达到平衡状态,故c选;
d.根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以容器内密度保持不变不能说明反应是否达到平衡状态,故d不选;
故选bc;
(3)a.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,故a错误;
b.适当升高温度,反应速率增大,故b正确;
c.增大O2的浓度,反应速率增大,故c正确;
d.选择高效的催化剂,增大反应速率,故d正确;
故选bcd。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】有机物a、b、c在一定条件下的转化关系如图所示。下列说法正确的是
![]()
A. a中所有碳原子处于同一平面
B. b可用于萃取溴水中的溴
C. ①②均属于加成反应
D. 等物质的量的b、c分别完全燃烧,耗氧量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2气体缓缓地通入到含KOH、Ba(OH)2和K[Al(OH)4]的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是
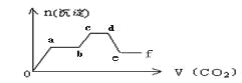
A. o—a段反应的化学方程式是:Ba(OH)2 + CO2 = BaCO3↓+ H2O
B. b—c段反应的离子方程式是:2[Al(OH)4]-+ CO2 = 2Al(OH)3↓ +CO32-+ H2O
C. a—b段与c—d段所发生的反应相同
D. d—e段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几家工厂利用废气、废液、废渣联合生产化肥硫酸铵的工艺:
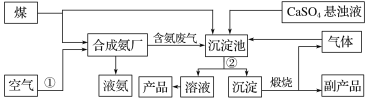
请回答下列问题:
(1)操作②为______________________________________________________。
(2)工业合成氨的化学方程式为_____________________。
(3)沉淀池中生成硫酸铵的化学方程式________________________________________。
(4)在实验室中检验氨气的方法是_________________________________。
(5)副产品的化学式为________。该联合生产工艺中可以循环使用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是( )
A. “千淘万漉虽辛苦,吹尽黄沙始到金”中“淘”“漉”相当于分离提纯操作中的“过滤”
B. 司母戊鼎属青铜制品,是我国古代科技光辉成就的代表之一
C. 瓷器(China)属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象
D. 侯德榜是我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
选项 | 试剂 | 实验目的 | 实验装置 | ||
X | Y | Z |
| ||
A | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
B | 石灰石 | 浓盐酸 | Na2SiO3溶液 | C元素非金属性大于Si元素 | |
C | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
D | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 | |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
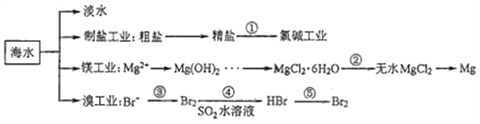
A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),图甲表示该反应过程中能量的变化。
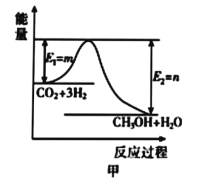
(1)在固定容积的密闭容器内,下列能说明该反应已经达到平衡状态的是______。
A.单位时间内生成n mol CO2的同时生成 3n molH2
B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH)
D.1mol CH3OH中H—O键断裂的同时2mol C=O键断裂
E.混合气体的密度不再改变的状态
F.混合气体的平均相对分子质量不变
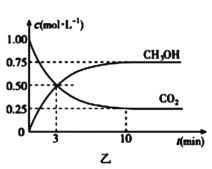
(2)在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图乙所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=_______。容器内平衡时与起始时的压强之比为________。平衡时 CO2的转化率为________,平衡时CH3OH的体积分数为__________。
(3)下图是科学家正在研发的,以实现上述反应[CO2(g)+3H2(g)CH3OH(g)+H2O(g)]在常温常压下进行的装置。写出甲槽的电极反应式:_____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_____Ⅰ1(Cu)(填“大于”或“小于”)。原因是_____________________________。
(3)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________,SO42-、CS2、CO32-键角由大到小的顺序是______________________
(4)锌冶炼过程中会产生污染性气体二氧化硫,已知液态二氧化硫也可以发生类似水的自身电离2SO2![]() SO2++SO32-,S和O两种元素中电负性较强的是______________,与SO2+互为等电子体的单质分子是________(填化学式),SO2+中σ键和兀键数目比为___________。
SO2++SO32-,S和O两种元素中电负性较强的是______________,与SO2+互为等电子体的单质分子是________(填化学式),SO2+中σ键和兀键数目比为___________。
(5)分析并比较物质A: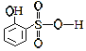 与B:
与B: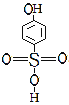 的沸点高低及其原因:__
的沸点高低及其原因:__
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com