
【题目】部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
A.V=224B.样品中Fe的质量为2.14g
C.样品中CuO的质量为3.52 gD.未氧化前Fe元素的质量分数约为41.2%
【答案】D
【解析】
A、滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,其物质的量=3.2g÷160g/mol=0.02mol,铁元素的物质的量为0.04mol,滤液A中溶质为过量H2SO4和FeSO4,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,故合金中氧原子的物质的量(5.76g-3.2g-2.24g)÷16g/mol=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08mol﹣0.04mol=0.04mol H+生成氢气,即生成0.02mol氢气,标况体积=0.02mol×22.4L/mol=0.448L=448mL,A错误;
B、固体为三氧化二铁,其物质的量为0.02mol,铁元素的量为0.02mol×2=0.04mol,质量为:0.04mol×56g/mol=2.24g,B错误;
C.由于硫酸过量,生成氢气,滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为3.2g÷64g/mol=0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,但是不能确定CuO的具体质量,C错误;
D、合金中Fe元素的质量为:56g/mol×0.04mol=2.24g,Cu的质量为3.2g,则未氧化前Fe元素的质量分数约为![]() ×100%=41.2%,D正确;
×100%=41.2%,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】某有机物X是一种免疫调节剂,其结构简式为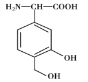 ,下列有关X的说法中错误的是
,下列有关X的说法中错误的是
A.其共平面碳原子最多有9个
B.既能与钠反应也能与NaHCO3溶液反应
C.能发生加成反应
D.X分子间能发生取代反应但分子内不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的铜和 Fe2O3 的混合物中加入 200mL1.5 mol·L-1的稀硫酸,完全反应后固体无剩余,得到的溶液中只有两种溶质,假设反应前后溶液体积不变,则下列说法正确的是( )
A.原混合物中 Cu 和 Fe2O3 的质量之比为 1∶2
B.反应后的溶液中 CuSO4 的物质的量的浓度为 1mol/L
C.若用 CO 还原等质量的原混合物,充分反应后,质量将减少 4.8 克
D.该反应过程均发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质 A、B 和气体甲、乙、丙以及物质 C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
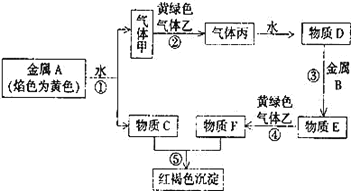
请回答下列问题:
(1) A 的化学式为_____,F 的化学式为_____;
(2) 写出 C 溶液与 Al 反应的离子方程式_____。
(3) 写出 C 溶液与黄绿色气体乙反应的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=8.0×10-38,Kb(NH3·H2O)=1.8×10-5,下列叙述中不正确的是
A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀
B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂
C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强
D.25℃时,![]() +H2O
+H2O![]() NH3·H2O+H+的平衡常数为5.6×10-10
NH3·H2O+H+的平衡常数为5.6×10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某氟化稀土样品中氟元素的质量分数进行如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量,实验装置如图所示。

(1)c的名称是________________
(2)检查装置气密性:在b和f中加水,水浸没导管a和e末端,______________(填操作步骤),微热c,容量瓶f有气泡冒出,导管a内形成一段水柱;停止加热,_________________________,说明装置气密性良好。
(3)c中加入一定体积高氯酸和m g氟化稀土样品,f中盛有滴加酚酞的NaOH溶液。加热b、c,使水蒸气进入c。
①向c中通水蒸气的目的是________________________________;
②c中除有HF气体外,可能还有少量SiF4(易水解)气体生成,若有SiF4生成,实验结果将__________(填“偏高”“偏低”或”不受影响”)。
③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因_______________________________。
(4)向馏出液中加入V1ml c1 mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2 mol·L-1 EDTA标准溶液滴定剩余的La3+(La3+与EDTA按1:1络合),消耗EDTA标准溶液V2 mL,则氟化稀土样品中氟的质量分数为____________(写出表达式即可,不需化简)。
(5)用样品进行实验前,需要用0.084g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏实验),测量并计算出氟元素质量,重复多次。该操作的目的是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
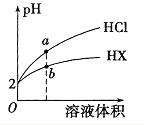
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是维持人体生命活动所必需的营养物质,下列叙述不正确的是( )
A.将碘酒滴到土豆片上,土豆片变蓝,说明碘元素均遇淀粉变蓝
B.工业上常用油脂在碱性条件下的水解反应来制肥皂
C.加热条件下,葡萄糖溶液能与新制![]() 悬浊液反应产生砖红色沉淀
悬浊液反应产生砖红色沉淀
D.蛋白质在浓硝酸作用下能发生颜色反应,可用来鉴别部分蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)=____________;用离子方程式表示FeCl3溶液用于净水的原因____________________________________。
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-。在NaHSO4溶液中c(H+)___________c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH__________7。
(3)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为_________________________________。(已知Ksp(BaSO4)=1.1×10-10)
(4)一定温度下,测得某纯水的pH为6.5。此时水的离子积常数Kw为_______;若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1的Ba(OH)2溶液,保持原温度,其溶液的pH为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com