
【题目】某有机物X是一种免疫调节剂,其结构简式为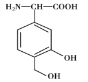 ,下列有关X的说法中错误的是
,下列有关X的说法中错误的是
A.其共平面碳原子最多有9个
B.既能与钠反应也能与NaHCO3溶液反应
C.能发生加成反应
D.X分子间能发生取代反应但分子内不能发生取代反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列离子的检验方法正确的是
A.向待测液中先加入硝酸钡溶液有白色沉淀,再加入稀盐酸,白色沉淀不消失,可以确认待测液中含有SO![]()
B.向待测液中加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,可以确认待测液中含有NH![]()
C.向待测液中先加入氯水,再滴入KSCN溶液,溶液变红,可以确认待测液中含有Fe2+
D.用玻璃棒蘸取待测液并在酒精灯火焰上灼烧,火焰呈黄色,可以确认待测液中含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA-A键和1molB-B键,放出akJ能量
C.该反应中反应物的总能量高于产物的总能量
D.该反应热为(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:

①关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态_________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是_________________________________________。
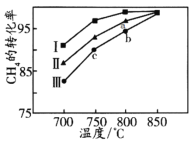
(2)在一刚性密闭容器中,加入Ni/α-Al2O3催化剂并加热至1123K,使CH4和CO2发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),初始时CH4和CO2的分压分别为20kPa、25kPa,研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量的蔗糖(C12H22O11)放入烧杯,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。可观察到固体变黑,片刻后,黑色物质急剧膨胀,同时产生大量刺激性气味的气体,放出大量的热。(如下图所示)

(1)固体变黑体现了浓硫酸的________性(填“吸水”、“脱水”或“强氧化”)。
(2)确定刺激性气味气体的成分。
①将气体通入品红溶液后,溶液褪色,加热,颜色恢复。说明该气体中一定含有______。
②将气体通入澄清石灰水,溶液变浑浊,______(填“能”或 “不能”)证明气体中含有二氧化碳,其理由是________________。
③刺激性气味气体产生的原因可用如下化学方程式表示,完成化学方程式:_________。
(3)大量燃煤会产生与上述混合气体相同的废气,不仅污染空气还可能导致__________,请你提出至少一条防治措施____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.2 mol·L-1的HX溶液中c(HX):c(X-)=99:1,下列说法正确的是
A.升温至 30℃时,溶液 c(HX):c(X)=99:1B.25℃时K(HX)≈2×l0-5
C.向溶液中加入适量NaX溶液,酸的电离平衡向左移动,新平衡时c(X-)减小D.加水稀释后,溶液中c(X-)、c(H+)、c(OH-)均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态钛原子的电子排布式为______,若钙原子核外有7种能量状态的电子,则钙原子处于____(填“基”或“激发”)态,氧元素所在周期第一电离能由小到大的前三种元素依次是_______。
(2)硅能形成一系列硅氢化合物,如硅烷系列:SiH4、Si2H6;硅烯系列:Si2H4、Si3H6等,其中硅烷广泛应用于微电子、制造太阳能电池。
①上述分子中硅原子存在sp2杂化的是____,属于正四面体的是_____。
②硅烷链长度远小于烷烃,最可能的原因是______,硅烷同系物熔、沸点的变化规律可能是________.
(3) CaTiO3的晶胞为立方晶胞,结构如下图所示:
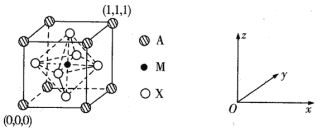
则与A距离最近且相等的X有___个,M的坐标是_____;若晶胞参数是r pm, NA为阿伏加德罗常数的值,则该晶体的密度是_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有NaHSO4、Ba(OH)2、NH3·H2O、NaHCO3、KAl(SO4)2五种无色溶液,现欲通过它们之间的相互反应的现象对其进行鉴别。部分物质间的反应现象如表。
A | B | C | D | E | |
A | ↓ | ||||
B | ↑ | ↓ | |||
C | ↑ | ↑↓ | ↓ | ||
D | ↓ | ↑↓ | ↓ | ||
E | ↓ | ↓ | ↓ |
表中“↑”表示生成气体物质,“↓”表示生成沉淀。根据以上信息,回答以下问题。
(1)B,E的化学式分别为________、________。
(2)写出A的电离方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
A.V=224B.样品中Fe的质量为2.14g
C.样品中CuO的质量为3.52 gD.未氧化前Fe元素的质量分数约为41.2%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com