
【题目】将适量的蔗糖(C12H22O11)放入烧杯,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。可观察到固体变黑,片刻后,黑色物质急剧膨胀,同时产生大量刺激性气味的气体,放出大量的热。(如下图所示)

(1)固体变黑体现了浓硫酸的________性(填“吸水”、“脱水”或“强氧化”)。
(2)确定刺激性气味气体的成分。
①将气体通入品红溶液后,溶液褪色,加热,颜色恢复。说明该气体中一定含有______。
②将气体通入澄清石灰水,溶液变浑浊,______(填“能”或 “不能”)证明气体中含有二氧化碳,其理由是________________。
③刺激性气味气体产生的原因可用如下化学方程式表示,完成化学方程式:_________。
(3)大量燃煤会产生与上述混合气体相同的废气,不仅污染空气还可能导致__________,请你提出至少一条防治措施____________________。
【答案】脱水 SO2 不能 SO2也能使石灰水变浑浊 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 酸雨 可在燃煤中加入生石灰脱硫
CO2↑+2SO2↑+2H2O 酸雨 可在燃煤中加入生石灰脱硫
【解析】
浓硫酸具有脱水性,能够将氧化物中的H、O以2:1组成脱去,反应产生碳单质,可以被浓硫酸氧化产生CO2、SO2、H2O,SO2具有漂白性,能够使品红溶液褪色,CO2、SO2都可以与Ca(OH)2反应,产生不溶性的物质而变浑浊,SO2是大气污染物,会导致酸雨的形成,可结合其是酸性氧化物,能够与碱性物质反应的性质,在燃煤中加热CaO或CaCO3将其反应转化为固体物质进入滤渣,排除其对环境的污染。
(1)蔗糖是有机物,分子式是C12H22O11,将其放入烧杯,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。可观察到固体变黑,这是由于浓硫酸具有脱水性,将蔗糖中的H、O以2:1组成脱去,剩余固体物质为黑色的C单质;
(2)①将气体通入品红溶液后,溶液褪色,说明气体具有漂白性,将无色物质加热,溶液颜色恢复,说明该气体中一定含有SO2;
②将气体通入澄清石灰水,溶液变浑浊,不能证明气体中含有二氧化碳,原因是CO2、SO2都能与Ca(OH)2反应,产生使石灰水变浑浊的固体物质。
③产生刺激性气味气体是由于浓硫酸具有强的氧化性,将脱水产生的C单质氧化,硫酸钡还原产生SO2,同时有水生成,反应的化学方程式为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(3)大量燃煤,煤中的S元素会燃烧变为SO2气体进入大气,不仅污染空气还可能导致酸雨的形成,防治措施可以是在燃煤中加入生石灰脱硫,反应方程式为CaO+SO2![]() CaSO3,2CaSO3+O2
CaSO3,2CaSO3+O2![]() 2CaSO4,使S元素进入滤渣,从而可减少对大气的污染。
2CaSO4,使S元素进入滤渣,从而可减少对大气的污染。


科目:高中化学 来源: 题型:
【题目】钛是二十一世纪的“明星金属”,工业制备金属钛是以金红石为原料,发生的反应如下。
反应Ⅰ:aTiO2+bCl2+cC![]() aTiCl4+cCO
aTiCl4+cCO
反应Ⅱ:TiCl4+2Mg ![]() Ti+2MgCl2
Ti+2MgCl2
下列关于反应Ⅰ、Ⅱ的说法中正确的是 ( )
A.反应Ⅰ中TiO2是氧化剂
B.TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂
C.a=b=c=2
D.每生成9.6 g Ti,反应Ⅱ中转移了0.6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
B.用FeCl3腐蚀印刷电路板:Cu+Fe3+=Cu2++Fe2+
C.在碳酸氢钙溶液中加入少量苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.Fe与水蒸气反应:2Fe+3H2O(g)![]() Fe2O3+3H2
Fe2O3+3H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴蓝(化学式Al2CoO4)是一种耐热、耐光、耐酸、耐碱腐蚀的蓝色颜料。某企业利用含铝锂钴废料(铝箱、CoO和Co2O3、Li2O)制备钴蓝的工艺流程如下:
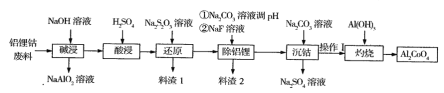
回答下列问题:
(1)碱浸时要有防火、防爆措施,原因是______,操作I的内容是_______。
(2)在实验室模拟工业生产时,也可用盐酸酸浸出钴,但实际工业生产中却不用盐酸,请 从反应原理分析不用盐酸浸出钴的主要原因___。
(3)写出“还原”过程中反应的离子方程式____。
(4)料渣2的主要成分是A1(OH)3 、____,写出灼烧时反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定条件下一定能大共存的是
A.c(H+)=c(OH-)溶液中:Fe3+、K+、Cl-、SO42-
B.麦芽糖溶液中:SO42-、MnO4-、K+、H+
C.![]() =1×1012的溶液中:Mg2+、Cu2+、SO42-、C1﹣
=1×1012的溶液中:Mg2+、Cu2+、SO42-、C1﹣
D.遇BaCl2能产生不溶于稀硝酸的白色沉淀的溶液中:NH4+、Ca2+、NO3﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X是一种免疫调节剂,其结构简式为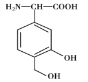 ,下列有关X的说法中错误的是
,下列有关X的说法中错误的是
A.其共平面碳原子最多有9个
B.既能与钠反应也能与NaHCO3溶液反应
C.能发生加成反应
D.X分子间能发生取代反应但分子内不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中的硫酸盐会加剧雾霾的形成,我国科学家用下列实验研究其成因:反应室底部盛有不同吸收液。将SO2和NO2按一定比例混合,以N2或空气为载气通入反应室,相同时间后,检测吸收液中SO42-的含量数据如下表所示,下列说法正确的是
反应室 | 载气 | 吸收液 | SO42-含量 | 数据分析 |
① | N2 | 蒸馏水 | a | b |
② | 3%氨水 | b | ||
③ | 空气 | 蒸馏水 | c | |
④ | 3%氨水 | d |
A.实验表明:酸性环境下,更有利于硫酸盐的形成
B.本研究表明:硫酸盐的形成主要与N2有关
C.反应室①中可能发生反应:SO2+2NO2+2H2O=H2SO4+2HNO2
D.燃煤产生的气体盲目排放会引起酸雨但不会加剧雾霾形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
Ⅰ.pH=2 时, NaNO2 溶液只能将 I-氧化为 I2,同时生成 NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.I2在碱性溶液中反应生成I-和IO3-。
(1)反应①的离子方程式_____。
(2)方案甲中,根据 I2的特性,分离操作 X 的名称是_____。
(3)Cl2、酸性 KMnO4 等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是_____。
(4)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-、IO3-。 请检验滤液中的I-,将实验方案补充完整。实验中可供选择的试剂:稀 H2SO4、淀粉溶液、Fe2(SO4)3 溶液。
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B._____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=8.0×10-38,Kb(NH3·H2O)=1.8×10-5,下列叙述中不正确的是
A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀
B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂
C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强
D.25℃时,![]() +H2O
+H2O![]() NH3·H2O+H+的平衡常数为5.6×10-10
NH3·H2O+H+的平衡常数为5.6×10-10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com