
【题目】钴蓝(化学式Al2CoO4)是一种耐热、耐光、耐酸、耐碱腐蚀的蓝色颜料。某企业利用含铝锂钴废料(铝箱、CoO和Co2O3、Li2O)制备钴蓝的工艺流程如下:
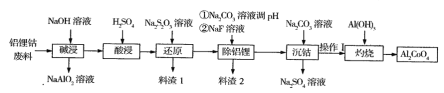
回答下列问题:
(1)碱浸时要有防火、防爆措施,原因是______,操作I的内容是_______。
(2)在实验室模拟工业生产时,也可用盐酸酸浸出钴,但实际工业生产中却不用盐酸,请 从反应原理分析不用盐酸浸出钴的主要原因___。
(3)写出“还原”过程中反应的离子方程式____。
(4)料渣2的主要成分是A1(OH)3 、____,写出灼烧时反应的化学方程式______。
【答案】Al与NaOH溶液反应时有可燃性气体生成 过滤、洗涤 Co2O3可氧化盐酸产生Cl2污染环境 8Co3++S2O32- +5H2O= 8Co2++2SO42- +10H+ LiF CoCO3+2Al(OH)3![]() Al2CoO4+CO2↑+3H2O
Al2CoO4+CO2↑+3H2O
【解析】
(1)碱浸时有氢气生成,氢气是一种可燃性气体;沉钴时得到CoCO3沉淀;
(2)盐酸具有还原性,能被Co2O3氧化生成有毒的氯气而污染环境;
(3)酸浸时Co2O3转化为Co2(SO4)3,还原时Co3+被Na2S2O3还原为Co2+;
(4)除铝锂时,A1转化为Al(OH)3, Li+转化为LiF。
(1)碱浸时有氢气生成,氢气是一种可燃性气体,故碱浸时要有防火、防爆措施;
沉钴时得到CoCO3沉淀,故操作I是过滤及洗涤;
(2)盐酸具有还原性,能被Co2O3氧化生成有毒的氯气而污染环境;
(3)酸浸时Co2O3转化为Co2(SO4)3,还原时Co3+被Na2S2O3还原为Co2+,离子方程式为8Co3++S2O32- +5H2O= 8Co2++2SO42- +10H+;
(4)除铝锂时,A1转化为Al(OH)3, Li+转化为LiF。 灼烧时,Al(OH)3 与CoCO3作用生成Al2CoO4, 另外有CO2、H2O生成,灼烧时反应的化学方程式为CoCO3+2Al(OH)3![]() Al2CoO4+CO2↑+3H2O。
Al2CoO4+CO2↑+3H2O。


科目:高中化学 来源: 题型:
【题目】甲、乙两个化学兴趣小组,分别做乙醇催化氧化并验证产物的实验。甲组实验设计如图1所示,乙组实验设计如图2所示,密闭系统内空气很少。请填写下列空白:


(1)甲组要完成全部实验内容,以下步骤中正确的顺序是 _____ (填序号,步骤可重复)。
①加热 ②检查装置的气密性 ③向A中缓缓鼓入干燥的空气 ④取下D装置
(2)甲、乙两组实验中,给定的A~H中需要加热的是________(填编号)。
(3)反应开始后,C中观察到的现象是________。
(4)写出E中发生反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400K、101.3Kpa时,1.5L某烃蒸气能在aL氧气中完全燃烧,体积增大至(a+3)L(相同条件下),若a=8时,该烃可能的分子式( )
A.CH4B.C2H6C.C3H8D.C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是

A.每生成2分子AB吸收bkJ热量
B.断裂1molA-A键和1molB-B键,放出akJ能量
C.该反应中反应物的总能量高于产物的总能量
D.该反应热为(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
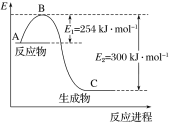
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:
(1)CH4超干重整CO2的催化转化如图所示:

①关于上述过程Ⅱ的说法不正确的是________(填序号)。
a.实现了含碳物质与含氢物质的分离
b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应
d.Fe3O4、CaO为催化剂,降低了反应的ΔH
②其他条件不变,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态_________(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是_________________________________________。
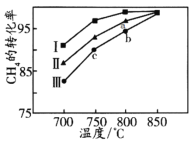
(2)在一刚性密闭容器中,加入Ni/α-Al2O3催化剂并加热至1123K,使CH4和CO2发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),初始时CH4和CO2的分压分别为20kPa、25kPa,研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某时刻测得p(CO)=20kPa,则p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量的蔗糖(C12H22O11)放入烧杯,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。可观察到固体变黑,片刻后,黑色物质急剧膨胀,同时产生大量刺激性气味的气体,放出大量的热。(如下图所示)

(1)固体变黑体现了浓硫酸的________性(填“吸水”、“脱水”或“强氧化”)。
(2)确定刺激性气味气体的成分。
①将气体通入品红溶液后,溶液褪色,加热,颜色恢复。说明该气体中一定含有______。
②将气体通入澄清石灰水,溶液变浑浊,______(填“能”或 “不能”)证明气体中含有二氧化碳,其理由是________________。
③刺激性气味气体产生的原因可用如下化学方程式表示,完成化学方程式:_________。
(3)大量燃煤会产生与上述混合气体相同的废气,不仅污染空气还可能导致__________,请你提出至少一条防治措施____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态钛原子的电子排布式为______,若钙原子核外有7种能量状态的电子,则钙原子处于____(填“基”或“激发”)态,氧元素所在周期第一电离能由小到大的前三种元素依次是_______。
(2)硅能形成一系列硅氢化合物,如硅烷系列:SiH4、Si2H6;硅烯系列:Si2H4、Si3H6等,其中硅烷广泛应用于微电子、制造太阳能电池。
①上述分子中硅原子存在sp2杂化的是____,属于正四面体的是_____。
②硅烷链长度远小于烷烃,最可能的原因是______,硅烷同系物熔、沸点的变化规律可能是________.
(3) CaTiO3的晶胞为立方晶胞,结构如下图所示:
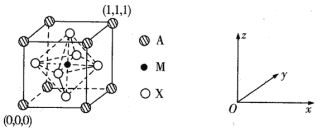
则与A距离最近且相等的X有___个,M的坐标是_____;若晶胞参数是r pm, NA为阿伏加德罗常数的值,则该晶体的密度是_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是分离混合物时常用的仪器,回答下列问题:
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]() E.
E. 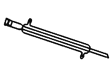
(1)写出仪器 C、E 的名称_____ 、_____。
(2)分离以下混合物应该主要选用上述什么仪器(填字母符号)a.粗盐和泥沙:____b.花生油和水:____
(3)下列实验与物质微粒大小无直接关系的是_____
A.过滤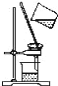 B.渗析
B.渗析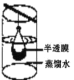 C.萃取
C.萃取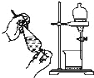 D.丁达尔效应
D.丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com