
【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态钛原子的电子排布式为______,若钙原子核外有7种能量状态的电子,则钙原子处于____(填“基”或“激发”)态,氧元素所在周期第一电离能由小到大的前三种元素依次是_______。
(2)硅能形成一系列硅氢化合物,如硅烷系列:SiH4、Si2H6;硅烯系列:Si2H4、Si3H6等,其中硅烷广泛应用于微电子、制造太阳能电池。
①上述分子中硅原子存在sp2杂化的是____,属于正四面体的是_____。
②硅烷链长度远小于烷烃,最可能的原因是______,硅烷同系物熔、沸点的变化规律可能是________.
(3) CaTiO3的晶胞为立方晶胞,结构如下图所示:
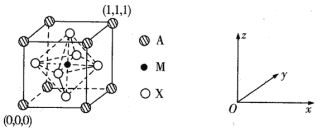
则与A距离最近且相等的X有___个,M的坐标是_____;若晶胞参数是r pm, NA为阿伏加德罗常数的值,则该晶体的密度是_____g/cm3。
【答案】[Ar]3d24s2 激发 Li<B<Be Si2H4、Si3H6 SiH4 原子半径Si>C,Si-Si长度大于C-C,键能较小,键的稳定性较差,不利于形成长链 随着相对分子质量的增大而升高 12 (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(1)钛是22号元素。从左到右,第一电离能增大;
(2)硅原子最外层有4个电子,乙硅烯、丙硅烯分子中,均有硅原子形成了3个σ键;
(3)观察晶胞图知,顶点A紧邻等距离最近的X位于晶胞的三个平面,即横平面、正平面和侧平面,将每个平面扩展,则每个平面中距离A最近的X均有4个,故共有3×4=12个。
(1)钛是22号元素,电子排布式为[Ar]3d24s2。基态钙原子的20个电子分占6个不同的能级,即电子有6种能量状态,现在有7种能量状态,说明它处于激发态。从左到右,第一电离能增大,Be (2s2) s能级全充满是稳定状态,故由小到大的前三种元素是Li<B<Be。
(2)硅原子最外层有4个电子,乙硅烯、丙硅烯分子中,均有硅原子形成了3个σ键,故二者分子中均有硅原子为sp2 杂化。甲硅烷分子中硅为sp3杂化,是正四面体结构。原子半径Si>C,Si-Si长度大于C-C,键能较小,键的稳定性较差,不利于形成长链。硅烷同系物组成、结构相似,随着分子中硅原子数目的增加,熔、沸点升高。
(3)观察晶胞图知,顶点A紧邻等距离最近的X位于晶胞的三个平面,即横平面、正平面和侧平面,将每个平面扩展,则每个平面中距离A最近的X均有4个,故共有3×4=12个。M位于体心,故其坐标为(![]() ,
,![]() ,
,![]() )。根据均摊原理知,X是氧,一个晶胞中含有一个“CaTiO3”,晶胞的体积是1×10-30r3cm3,由此可求出其密度为
)。根据均摊原理知,X是氧,一个晶胞中含有一个“CaTiO3”,晶胞的体积是1×10-30r3cm3,由此可求出其密度为![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】向含0.2molAlCl3的溶液中加入了一定量的1mol/L的NaOH溶液后,生成了7.8g的沉淀,则加入的NaOH溶液的体积可能为( )
A.150mLB.200mLC.700mLD.400mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴蓝(化学式Al2CoO4)是一种耐热、耐光、耐酸、耐碱腐蚀的蓝色颜料。某企业利用含铝锂钴废料(铝箱、CoO和Co2O3、Li2O)制备钴蓝的工艺流程如下:
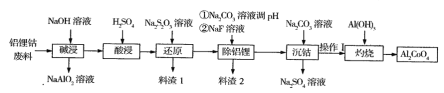
回答下列问题:
(1)碱浸时要有防火、防爆措施,原因是______,操作I的内容是_______。
(2)在实验室模拟工业生产时,也可用盐酸酸浸出钴,但实际工业生产中却不用盐酸,请 从反应原理分析不用盐酸浸出钴的主要原因___。
(3)写出“还原”过程中反应的离子方程式____。
(4)料渣2的主要成分是A1(OH)3 、____,写出灼烧时反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X是一种免疫调节剂,其结构简式为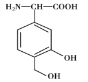 ,下列有关X的说法中错误的是
,下列有关X的说法中错误的是
A.其共平面碳原子最多有9个
B.既能与钠反应也能与NaHCO3溶液反应
C.能发生加成反应
D.X分子间能发生取代反应但分子内不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中的硫酸盐会加剧雾霾的形成,我国科学家用下列实验研究其成因:反应室底部盛有不同吸收液。将SO2和NO2按一定比例混合,以N2或空气为载气通入反应室,相同时间后,检测吸收液中SO42-的含量数据如下表所示,下列说法正确的是
反应室 | 载气 | 吸收液 | SO42-含量 | 数据分析 |
① | N2 | 蒸馏水 | a | b |
② | 3%氨水 | b | ||
③ | 空气 | 蒸馏水 | c | |
④ | 3%氨水 | d |
A.实验表明:酸性环境下,更有利于硫酸盐的形成
B.本研究表明:硫酸盐的形成主要与N2有关
C.反应室①中可能发生反应:SO2+2NO2+2H2O=H2SO4+2HNO2
D.燃煤产生的气体盲目排放会引起酸雨但不会加剧雾霾形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室用二氧化锰和浓盐酸共热制备并收集纯净、干燥的氯气,并进行氯气性质的探究。
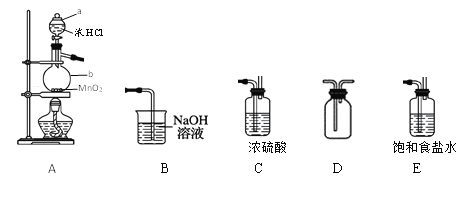
(1)仪器a、b的名称是____。
(2)以上装置A、B、C、D、E从左到右的连接顺序为____________。
(3)如何检查装置A的气密性?____。
(4)装置A中发生反应的离子方程式为____。
(5)装置B的作用是___,有同学觉得此装置不够完善,请你提出改进意见_____。
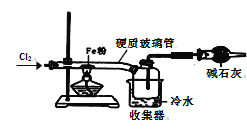
(6)该小组同学设计如图所示装置探究氯气的氧化性。通入氯气时硬质玻璃管中的现象是__,原因是__(用化学方程式解释)。
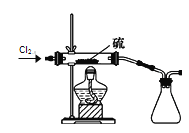
(7)二氯化硫(S2Cl2)在工业上用于橡胶的硫化。为了在实验室合成S2Cl2,该小组用下图装置将干燥的氯气在110~140℃与硫反应,即可得S2Cl2粗品。写出发生反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
Ⅰ.pH=2 时, NaNO2 溶液只能将 I-氧化为 I2,同时生成 NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.I2在碱性溶液中反应生成I-和IO3-。
(1)反应①的离子方程式_____。
(2)方案甲中,根据 I2的特性,分离操作 X 的名称是_____。
(3)Cl2、酸性 KMnO4 等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是_____。
(4)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-、IO3-。 请检验滤液中的I-,将实验方案补充完整。实验中可供选择的试剂:稀 H2SO4、淀粉溶液、Fe2(SO4)3 溶液。
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B._____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的铜和 Fe2O3 的混合物中加入 200mL1.5 mol·L-1的稀硫酸,完全反应后固体无剩余,得到的溶液中只有两种溶质,假设反应前后溶液体积不变,则下列说法正确的是( )
A.原混合物中 Cu 和 Fe2O3 的质量之比为 1∶2
B.反应后的溶液中 CuSO4 的物质的量的浓度为 1mol/L
C.若用 CO 还原等质量的原混合物,充分反应后,质量将减少 4.8 克
D.该反应过程均发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
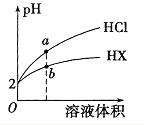
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com