
【题目】以Al2O3为原料制取氢氧化铝,最好的方法是( )
A.将Al2O3溶于水
B.将Al2O3先溶于盐酸中,之后滴加氢氧化钠溶液
C.将Al2O3先溶于盐酸中,之后滴加氨水
D.将Al2O3先溶于NaOH溶液中,之后滴加盐酸
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 可燃冰开采属于新能源的利用 B. MgO可作耐火材料
C. 晶体硅大量用于电子信息技术 D. 在含Br2的水溶液中,可用热空气吹出Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸氢钠受热容易分解为碳酸钠。现加热5.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则混合物中碳酸钠的质量为( )
A.3.38g
B.4.58g
C.4.16g
D.4.41g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
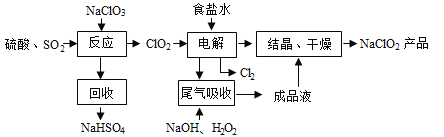
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式___________________。
(3)“电解”中阴极反应的主要产物是____________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为______________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________________。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向正反应方向移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应,(假设容器不参加反应)。若过滤后滤渣能被磁铁吸引,则溶液中不可能有( )
A.Fe3+
B.Fe2+和Cu2+
C.Fe3+和Cu2+
D.Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
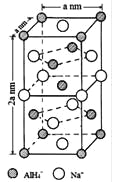
(1)基态Ti原子的价电子轨道表示式为 。
(2)NaH的熔点为800℃,不溶于有机溶剂,NaH属于 晶体,其电子式为 。
(3)AlH4-中,Al的轨道杂化方式为 ;例举与AlH4-空间构型相同的一种离子和一种分子 、 (填化学式)。
(4)NaAlH4晶体中,与AlH4-紧邻且等距的Na+有 个;NaAlH4晶体的密度为 gcm-3(用含a的代数式表示).若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式)。
(5)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,分子中有两个配位键,蒸气分子的结构式为 (标明配位键)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构.这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁矿石(若只含铁的氧化物和SiO2)取36g溶于过量的稀盐酸中,过滤、洗涤、干燥后得5.6g不溶物,向得到的滤液中加入足量的NaOH溶液,过滤、洗涤后将沉淀灼烧,得32g红棕色固体.根据题意下列结论不正确的是( )
A. 由铁矿石转化为红棕色固体的过程中发生了氧化还原反应
B. 溶于盐酸后得到的滤液中n(Fe2+):n(Fe3+)=1:1
C. 铁矿石中的铁的氧化物的化学式一定是Fe3O4
D. 若稀盐酸为3.0molL﹣1 400mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是0.5molL﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com