
【题目】根据氧化还原反应CuSO4+Zn=ZnSO4+Cu,可设计如下原电池装置:

⑴该原电池电解质溶液中的溶质是_______。
⑵电极A可选用:____,该电极的反应现象是:_____。
⑶电极B只能用:____,该电极的反应现象是:_____。
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是_________。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:____________________________________________________________________。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有________________(填化学性质)。
(3)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
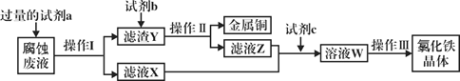
回答下列问题:
①试剂a是___________,操作I用到的玻璃仪器有烧杯、玻璃棒和___________。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________。
③上述流程中操作III包括________________、________________、过滤、洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化学电源在生产生活中有着广泛的应用,电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
(1)写出放电时负极的电极反应式:___;
(2)铅蓄电池放电时,溶液的pH将_________(填“增大”、“减小”或“不变”)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
(3)放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
Ⅱ.人们习惯上把电解饱和食盐水的工业叫做氯碱工业。如下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液。请回答以下问题:
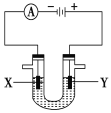
(4)X极上的电极反应式是:__________。
(5)检验Y电极反应产物的方法是_______。
(6)电解饱和NaCl溶液的离子方程式是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近20年来,对以氢气作为未来的动力燃料氢能源的研究得到了迅速发展。像电一样,氢是一种需要依靠其他能源,如石油、煤、原子能等的能量来制取的“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为“一级能源”,如煤、石油、太阳能和原子能等。发展民用氢能源,首先必须制得廉价的氢气。
⑴氢气燃烧时耗氧量小,发热量大。已知热化学方程式为:
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
C(g)+O2(g)=CO2(g) △H=-393.5 kJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生的热量的比值是________(保留两位小数)。
⑵某些科学家对以下3个反化学反应很感兴趣:
①3FeCl2+4H2O=Fe3O4+6HCl+H2
②2Fe3O4+3Cl2+12HCl=6FeCl3+6H2O+O2
③6FeCl3=6FeCl2+3Cl2
科学家研究上述反应意义在于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pBa=-lgc(Ba2+),Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=3.0×10-9。常温下,用 0.1 mol·L-1Na2SO4溶液滴定 20 mL 0.1 mol·L-1BaCl2溶液的曲线如图所示,V0达到滴定终点,下列说法错误的是
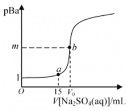
A.图像中,m=5,V0=20
B.若将c(BaCl2)从 0.1 mol· L-1变为 0.2 mol· L-1,m 值将减小
C.a 点溶液中离子浓度大小关系为:c(Cl-)>c(Na+)>c(Ba2+)>c(OH-)
D.向b点溶液中滴加Na2CO3溶液至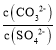 ≥30 时将生成BaCO3
≥30 时将生成BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.01molL-1KAl(SO4)2溶液中的SO42-数目为0.02NA
B.用浓盐酸分别与MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
C.1molNH4NO3完全溶于稀氨水中,溶液呈中性,溶液中NH4+的数目为NA
D.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com