
【题目】铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是_________。
A.Fe B.FeCl2 C.FeCl3 D.Fe2O3
(2)当人体缺铁时,往往要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:____________________________________________________________________。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有________________(填化学性质)。
(3)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:
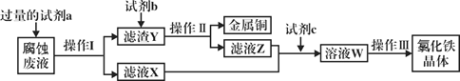
回答下列问题:
①试剂a是___________,操作I用到的玻璃仪器有烧杯、玻璃棒和___________。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________。
③上述流程中操作III包括________________、________________、过滤、洗涤。
【答案】A 研细后用盐酸溶解,滴入KSCN溶液,若溶液变红色,说明已被氧化 还原性 铁(Fe) 漏斗 2Fe2++Cl2=2Fe3++2Cl 蒸发浓缩 冷却结晶
【解析】
(1)当元素处于最高价态时只有氧化性,处于最低价态时只有还原性,处于中间价态时既有氧化性又有还原性;
(2)①根据Fe3+能与KSCN溶液反应导致溶液呈血红色分析解答;②Fe3+具有氧化性,能被还原性物质还原生成Fe2+;
(3)腐蚀液中含有FeCl2、CuCl2,分离难溶性固体和溶液采用过滤方法,所以操作I为过滤;向腐蚀液中加入过量的试剂a,得到滤渣Y和滤液X,加入的a为Fe,滤渣Y为Cu、Fe,滤液X为FeCl2,向滤渣Y中加入试剂b为稀盐酸,然后过滤得到Cu和滤液Z,Z中含有FeCl2和过量稀盐酸,然后加入试剂c,应该加入氯水,将FeCl2氧化为FeCl3,最后将溶液W蒸发浓缩、冷却结晶、过滤得到氯化铁晶体,据此分析解答。
(1)处于最高价态的元素只有氧化性,处于最低价态的元素只有还原性,处于中间价态的元素既有氧化性又有还原性。A.Fe处于最低价态,只有还原性,故A正确;B.FeCl2中Fe元素处于中间价态,既有氧化性又有还原性,故B错误;C.FeCl3中Fe元素处于高价态,具有氧化性,故C错误;D.Fe2O3中Fe元素处于高价态,具有氧化性,故D错误;故选A;
(2)①Fe3+能与KSCN溶液反应生成络合物而导致溶液呈血红色,可以用KSCN溶液检验铁离子,其检验方法为研细后用盐酸溶解,滴入KSCN溶液,若溶液变红色,说明已被氧化,故答案为:研细后用盐酸溶解,滴入KSCN溶液,若溶液变红色,说明已被氧化;
②Fe3+具有氧化性,能被还原性物质还原生成Fe2+,服用维生素C,可使食物中的三价铁离子转化为二价铁离子,说明维生素C能被铁离子氧化,则维生素C具有还原性,故答案为:还原性;
(3)腐蚀液中含有FeCl2、CuCl2,分离难溶性固体和溶液采用过滤方法,所以操作I为过滤;向腐蚀液中加入过量的试剂a,得到滤渣Y和滤液X,加入的a为Fe,滤渣Y为Cu、Fe,滤液X为FeCl2,向滤渣Y中加入的试剂b为稀盐酸,然后过滤得到Cu和滤液Z,Z中含有FeCl2和过量稀盐酸,然后加入试剂c,应该加入氯水,将FeCl2氧化为FeCl3,最后将溶液W蒸发浓缩、冷却结晶、过滤得到氯化铁晶体;
①试剂a是Fe,操作I为过滤,用到的玻璃仪器有烧杯、玻璃棒和漏斗,故答案为:Fe;漏斗;
②滤液X、Z中都有同一种溶质氯化亚铁,它们转化为氯化铁的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
③上述流程中操作III包括蒸发浓缩、冷却结晶、过滤、洗涤,故答案为:蒸发浓缩;冷却结晶。


科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(MnS)=4.65×1014,Ksp(MnCO3)=2.24×1011,298K下,MnS、MnCO3(R2代表S2或CO32-)在水中的溶解曲线如图所示,下列说法正确的是
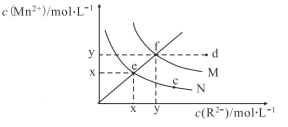
A.图象中x约等于2.2×107
B.其它条件不变,加热N的悬浊液可使溶液组成由e点沿ef线向f点方向移动
C.常温下,加水稀释M溶液可使溶液组成由d点沿df线向f点方向移动
D.向含有MnS和MnCO3的饱和溶液中加少量MnCl2,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
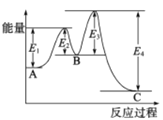
A. △H= E4- E3+E2-E1
B. 加入V2O5后反应经过两步完成,其中第一步决定反应速率
C. 加入V2O5,△H不变,但反应速率改变
D. 向密闭容器中充入2molSO2和1molO2,发生上述反应达平衡时,反应放热198kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() nC(g),达到平衡后,测得A气体的浓度为0.5mol/L。保持温度不变,将容器的容积扩大一倍,再达平衡时,测得A气体的浓度为0.3mol/L,则下列叙述中正确的是
nC(g),达到平衡后,测得A气体的浓度为0.5mol/L。保持温度不变,将容器的容积扩大一倍,再达平衡时,测得A气体的浓度为0.3mol/L,则下列叙述中正确的是
A、x+y<n B、该化学平衡向右移动
C、B的转化率增大 D、C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热化学方程式____。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热化学方程式_____。
(3)已知下列热化学方程式:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol;
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol;
③2H2(g)+O2(g)=2H2O(l ) ΔH3=-571.6kJ/mol,
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式C(s)+H2O(g) ![]() CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气完全反应生成一氧化碳气体和氢气,并吸热131.3kJ热量
D. 1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列说法不正确的是( )
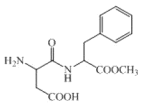
A.能使FeCl3溶液显紫色
B.该有机物不存在顺反异构
C.能发生取代反应和加成反应
D.1mol该有机物完全水解最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氧化还原反应CuSO4+Zn=ZnSO4+Cu,可设计如下原电池装置:

⑴该原电池电解质溶液中的溶质是_______。
⑵电极A可选用:____,该电极的反应现象是:_____。
⑶电极B只能用:____,该电极的反应现象是:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com