
分析 (1)先利用质量和质量数计算原子的物质的量,再由阴离子Xn-核外有x个电子,则质子数为x-n,利用质子数与中子数之和等于质量数来计算中子数;
(2)根据溶液呈电中性原则,溶液中应满足:c(K+)+c(H+)=2c(SO42-)+c(OH-)+c(Cl-),由于溶液中c(H+)=c(OH-),则:c(K+)=2c(SO42-)+c(Cl-),以此结合题中数据进行解答;
(3)NO2与水发生反应:3NO2+H2O═2HNO3+NO,NO2既是氧化剂又是还原剂,被氧化的NO2生成HNO3,被还原NO2的生成NO,由此分析解答;
(4)溶液具有均一性,浓度和体积的大小无关,根据m=nM=cVM来计算.
解答 解:(1)元素原子的质量数为A,w克这种元素的原子,其物质的量为$\frac{w}{A}$mol,
阴离子Xn-核外有x个电子,则质子数为x-n,
原子核内中子数为A-(x-n)=A-x+n,
则w克这种元素的原子核内中子数为$\frac{w}{A}$mol×(A-x+n)=$\frac{w(A-x+n)}{A}$mol,故答案为:$\frac{w(A-x+n)}{A}$mol;
(2)根据混合液中的电荷守恒可得:c(K+)+c(H+)=2c(SO42-)+c(OH-)+c(Cl-),由于溶液呈中性,则c(H+)=c(OH-),
所以c(K+)=2c(SO42-)+c(Cl-),则c(Cl-)=c(K+)-2c(SO42-)=1.2mol/L-0.4mol/L×=0.4mol/L,故答案为:0.4mol/L;
(3)NO2与水发生反应:3NO2+H2O═2HNO3+NO,NO2既是氧化剂又是还原剂,被氧化的NO2生成HNO3,被还原NO2的生成NO,所以氧化剂与还原剂的物质的量比为1:2,故答案为:3NO2+H2O═2HNO3+NO;1:2;
(4)溶液具有均一性,浓度和体积的大小无关,从1L 1mol•L-1NaCl溶液中取出200mL溶液,取出的溶液中NaCl的物质的量浓度是1mol/L,取出的溶液中NaCl的物质的量是n=cV=1mol/L×0.2L=0.2mol,质量是m=nM=0.2mol×58.5g/mol=11.7g,故答案为:1;0.2;11.7.
点评 本题考查学生物质的量浓度得有关计算等方面的知识,注意知识的归纳和梳理是关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸溶液 CH3COOH+NH3═CH3COONH4 | |
| B. | 澄清的石灰水跟盐酸反应 H++OH-═H2O | |
| C. | 碳酸钡溶于醋酸 BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应 Na+H2O═Na ++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
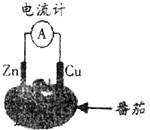
| A. | 电流由锌通过导线流向铜 | B. | 负极反应为Zn-2e-=Zn2+ | ||
| C. | 一段时间后,铜片质量会减少 | D. | 一段时间后,锌片质量会增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
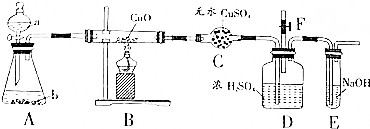
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ①③ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com