
【题目】化学与生产、生活密切相关,下列说法正确的是( )
A. SO2有漂白性,可广泛用于食品增白工业
B. 浓硫酸不能与Al反应,故可用铝槽车运送浓硫酸
C. 14C可用于文物年代鉴定,14C与12C互为同位素
D. 从海水中提取的所有物质都须通过化学反应才能实现
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】已知NaHSO4晶体易溶于水,它溶于水时,电离出三种不同的离子,电离方程式为:NaHSO4===Na+ + H+ + SO42-,因此NaHSO4溶液显酸性。但NaHSO4受热熔化时却只能电离出两种不同离子。
(1)NaHSO4在熔融状态下的电离方程式是________________。
(2)下列说法中正确的是________(填序号)。
A.NaHSO4属于酸 B.NaHSO4属于氢化物
C.NaHSO4晶体属于电解质 D.NaHSO4溶液能与Zn反应生成氢气
(3)向一定量的Ba(OH)2溶液中,逐滴加入NaHSO4溶液,直至不再生成沉淀,该过程中发生反应的离子方程式为:_________________________________________,沉淀完全后,继续滴加NaHSO4溶液,此时发生反应的离子方程式为:_____________。
(4)NaHSO4和NaHCO3中都含有氢元素,但将二者同时加入水中,可以发生化学反应,该反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素在元素周期表中的位置如图所示,已知:E元素原子的最外层电子数是次外层的2倍。下列说法不正确的是
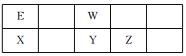
A. X有多种氢化物 B. 简单阴离子的半径:Y>Z
C. 气态氢化物的稳定性:W>Y>Z D. Y的氢化物与Z单质能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图,下列有关冰晶胞说法正确的是( )
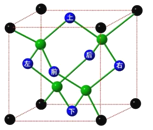
A. 冰晶胞内水分子间以共价键结合
B. 每个冰晶胞平均含有4个水分子
C. 水分子间的氢键具有方向性和饱和性,也是σ键的一种
D. 实验测得冰中氢键的作用力为18.5kJ/mol,而冰的熔化热为5.0kJ/mol,这说明冰熔化成水,氢键部分被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铁与氯化铁溶液反应:Fe+Fe3+===2Fe2+
B. 向次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO
C. 实验室用MnO2和浓盐酸制取Cl2: MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
D. 向NH4HCO3溶液中加过量的NaOH溶液:NH![]() +OH-===NH3↑+H2O
+OH-===NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曾有制药厂违反规定,购入工业用“二甘醇”代替医用丙二醇(C2H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇而死亡。二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,用途十分广泛。二甘醇一般的合成路线为:

请回答下列问题:
(1)下列关于“丙二醇和“二甘醇”及“乙二醇”的有关说法正确的是____________
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程I是石油加工中常用步骤,其名称为_______。
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,写出实验室制备E的化学方程式___________,则为了能得到二甘醇D,物质B到物质C的反应条件是_________,该反应属于________(填反应类型)。写出B可能生成E的化学方程式______。
(4)反应Ⅲ的化学方程式为:____________。
(5)A的一种同系物结构简式为 请用系统命名法对其命名_______________。
请用系统命名法对其命名_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定X的成分,设计并完成如下实验:
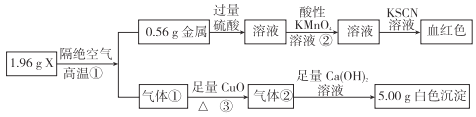
请回答:
(1)X的化学式是___________。
(2)反应②的离子方程式:___________。
(3)反应①的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA
B. 0.1 mol·L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA
C. 足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA
D. 常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com