
【题目】X、Y、Z、W 是常见的几种元素,其相关信息如表:
元素 | 相关信息 |
X | 原子核外有 3 个电子层,最外层比次外层少 1 个电子 |
Y | 食盐中添加少量 Y 的一种化合物预防 Y 元素缺乏 |
Z | Z 与钾的一种合金可用于快中子反应堆作热交换剂 |
W | W 的一种核素质量数为 24,中子数为 12 |
(1)元素 X 在海水中含量非常高,海水中含 X 元素的主要化合物是_____。工业上制取 X单质的化学方程式为_____。
(2)设计实验证明某水溶液中存在 Y 单质_____。
(3)Z 的元素符号为_____,其原子结构示意图为_____。
(4)W 与空气中含量最高的气体反应的产物化学式为_____。
【答案】NaCl 2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH 取该溶液少许于试管中,滴加几滴淀粉溶液,若溶液变蓝,则有I2 Na
Cl2↑+H2↑+2NaOH 取该溶液少许于试管中,滴加几滴淀粉溶液,若溶液变蓝,则有I2 Na 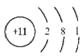 Mg3N2
Mg3N2
【解析】
X、Y、Z、W是常见的几种元素,X的原子核外有3个电子层,最外层比次外层少1个电子,可知最外层电子数为7,X为Cl;食盐中添加少量Y的一种化合物预防Y元素缺乏,Y为I;Z与钾的一种合金可用于快中子反应堆作热交换剂,Z为Na;W的一种核素质量数为24,中子数为12,W的质子数为12,W为Mg,以此来解答。
由上述分析可知,X为Cl、Y为I、Z为Na、W为Mg。
(1)元素X在海水中含量非常高,海水中含X元素的主要化合物是NaCl,工业上制取X单质的化学方程式为2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。
(2)设计实验证明某水溶液中存在Y单质的方法为取该溶液少许于试管中,滴加几滴淀粉溶液,若溶液变蓝,则有I2;
(3)Z的元素符号为Na,其原子结构示意图为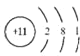 ;
;
(4)空气中含量最高的气体为氮气,则W与空气中含量最高的气体反应的产物化学式为Mg3N2。


科目:高中化学 来源: 题型:
【题目】(I)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反 应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;
(2)用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值________(填“偏 大”、“偏小”或“无影响”);
(3)实验中改用60 mL 0.50 mol/L 盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由________________________________________________________。
(Ⅱ).某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(4)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究e_______对反应速率的影响 |
② | 25 | 粗颗粒 | a______ | |
③ | b_______ | 粗颗粒 | 2.00 | |
④ | c________ | 细颗粒 | d______ |
(5)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下图装置的说法中正确的是( )

A. 溶液中pH明显下降
B. 铁片为正极,镀锌铁片为负极
C. 铁片的电极反应式:Fe-2e-=Fe2+
D. 电子由锌经溶液流向铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能大量共存的一组是…………………………………………( )
A.K+、NO3-、Na+、CO32-B.Na+、Cl-、H+、HCO3-
C.Mg2+、Al3+、Cl-、OH-D.Ca+、CO32-、K+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验方案可以从海洋生物中提取具有抗肿瘤活性的天然物质:
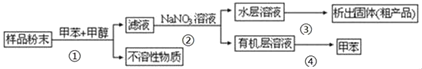
已知:甲苯,甲醇均为有机溶剂。
(1)指出抗肿瘤活性物质提取操作过程中有关的实验操作名称①_____④_____。
(2)操作①中用到的主要玻璃仪器有_____。
(3)操作②在用装置分液漏斗进行操作时,为使液体顺利滴下,应进行的具体操作是_____。 分液时要注意及时_____,防止上层液体流下。分液后漏斗内剩余的液体从分液漏斗 的_____(填“上口”或“下口”)倒入烧杯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常电动汽车使用的是锂电池,制备锂电池正极材料的主要原料为四氧化三钴,工业上用CoCl2·6H2O制备四氧化三钴。以水钴矿(主要成分为Co2O3、CoO、CuO、Fe2O3和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
(1)“酸浸”
①写出滤渣A主要成分的一种用途________。钴的浸出率随酸浸时间、温度的变化关系如图所示。综合考虑,应选择的最佳工艺条件为________。

②Co2O3与浓硫酸反应除生成CoSO4和H2O外,还生成的一种物质是________。
(2)“净化除杂”过程包括除铁、除铜等步骤。
①除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,写出反应的离子方程式____________________________________。
②除铜:加入适量Na2S2O3,发生反应2Cu2++2S2O32-+2H2O=Cu2S↓+S↓+4H++2SO42-,其中氧化产物为___________。
(3)“萃取和反萃取”
①试剂X的名称为_____________。
②实验室称取100 g原料(含钴11.80%),反萃取时得到浓度为0.036 mol·L-1的CoCl2溶液5 L,忽略损耗,钴的产率=_____________。
(4)以CoCl2·6H2O与NH4HCO3为原料,经两步经典反应合成四氧化三钴,第一步在80℃条件下二者生成Co2(OH)2CO3;第二步在600~820℃下Co2(OH)2CO3在空气中转化生成四氧化三钴,写出第二步反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为“21世纪的金属”,在工农业生产、医疗、国防、科技等方面中有着极其广泛而重要的用途。四氯化钛是工业上制备金属钛的重要原料。在常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4的反应原理为:TiO2+2C+2Cl2![]() =TiCl4+2CO。
=TiCl4+2CO。
下图是实验室模拟工业生产制备四氯化钛的反应装置,其主要操作步骤有(顺序己打乱):
①连接好整套装置,并检査装置的气密性;
②当锥形瓶中的TiCl4的量不再增加时,停止加热,改通CO2气体直至电炉中的瓷管冷却为止;
③将Ti02、炭粉混合均匀后,装入管式电炉中;
④将电炉升温至800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水;
⑤通入干燥的CO2气体并持续一段时间。

试回答:
(1)仪器F的名称是_______________,装罝A所用的试剂名称是_______________。
(2)正确的操作程序是(填写操作步骤的序号)______________________________。
(3)操作⑤的目的是______________________________。
(4)装置中冷凝管进水口的位置是(填a或b)_______________,装置E的作用_______________。
(5)将少量TiCl4露置于空气中,可能看到的现象是______________________________。
(6)利用化合物TiCl4可制备TiO2,请结合化学用语解释该过程:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com