
【题目】下列关于海水资源综合利用的说法中,不正确的是( )
A.从海水中富集镁元素可用Ca(OH)2沉淀法
B.海水淡化的方法主要有蒸馏法、离子交换法、电渗析法
C.从海水中提取溴单质的过程中用氯气做还原剂
D.从海水中获得粗盐可用蒸发结晶法
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L
B. 从1L2mol/L的H2SO4溶液中取出0.5L,该溶液溶质物质的量浓度为1mol/L
C. 0.5L2mol·L-1的BaCl2溶液中,Ba2+和Cl-的总数为3×6.02×1023
D. 10g98%的硫酸(密度为1.84g·cm-3)与10mL18.4mol·L-1的硫酸的浓度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细胞的结构和生命活动的物质基础是构成细胞的各种化合物,下列有关这些化合物功能的叙述,正确的是
A. 生命活动都由蛋白质调节
B. 干种子因缺乏自由水不能萌发
C. 多糖是植物细胞的能源物质
D. 生物的遗传物质是DNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校探究学习小组同学用含有少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取“化学纯”级的NaCl,实验前他们设计了如下方案(框图).

(1)请写出操作第④、⑤步所加试剂名称及第⑥步操作名称:
④_________,⑤_________,⑥_________;
(2)写出第⑤步操作中可能发生反应的化学方程式:________________________;
(3)如何用最简单方法检验第⑤步实验是否达到了目的:________________________;
(4)你认为该设计里哪些步骤调换后不影响实验结果:____________________________;
(5)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应。
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3 与 ΔH1、ΔH2 之间的关系是:ΔH3=________。
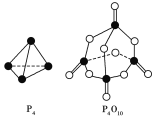
(2)白磷与氧气反应生成P4O10 固体 。下表所示是部分化学键的键能参数:
化学键 | P—P | P—O | P===O | O===O |
键能/kJ·mol-1 | a | b | c | d |
根据右图的分子结构和有关数据通过计算写出该反应的热化学方程式为 。
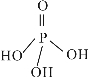
(3)三聚磷酸可视为三个磷酸分子(磷酸结构式如右下图)之间脱去两个水分子产物,其结构式为_________________,三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(4)已知298 K时白磷不完全燃烧的热化学方程式为:
P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1 638 kJ·mol-1。
在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是 和 (填分子式)。
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g)ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH= kJ·mol–1
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是 。
②在30 ℃、pH=4.0条件下,O3的分解速率为 mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为 (填字母)。
A.40 ℃、pH=3.0 B.10 ℃、pH=4.0 C.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。

①图中阴极为 (填“A”或“B”),其电极反应式为 。
②若C处通入O2,则A极的电极反应式为 。
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为 。(忽略O3的分解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)有以下微粒:①N2H4 ②P4 ③H2O ④N2 ⑤H3O+ ⑥NH4+ ⑦CO2 ⑧H2O2
(填编号)
(1)既有极性键又有非极性键的是 ;(2)既有σ键又有π键的是 ;
(3)微粒中不含孤电子对的是____________;(4)立体构型呈正四面体的是____________;
(5)⑤和⑧的电子式分别为 和 ;
(6)⑥和⑦的结构式分别为 和 ;
(二)以下反应均为放热反应,根据热化学方程式,比较 △H1 和 △H2 的大小
① I2(g)+ H2(g)=2HI(g) △H1;I2(s)+ H2(g)=2HI(g) △H2,则△H1 △H2
② H2(g)+Cl2(g)=2HCl(g) △H1;H2(g)+Br2(g)=2HBr(g) △H2,则△H1 △H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)质量之和为96克的O2和O3的气体混合,其氧原子个数为______________。
(2)现要配制1 mol·L1 Na2CO3溶液250 mL,求:①需要固体Na2CO3_____________g;②需要含结晶水的碳酸钠晶体(Na2CO3·10 H2O) g;③需要物质的量浓度为4 mol·L1的Na2CO3溶液 mL;④需要溶质的质量分数为12%、密度为1.12 g·cm-3的Na2CO3溶液 mL。
(3)在配制上述溶液的过程中,可能导致配制溶液浓度偏小的有:_________
A. 固体Na2CO3放在右盘(1 g以下用游码);
B. 容量瓶用碳酸钠溶液先润洗;
C. 转移溶液时未洗涤烧杯;
D. 定容时,溶液未冷却;
E. 定容时视线仰视;
F. 摇匀时,发现液面低于容量瓶刻度线,但未补加水;
G. 容量瓶未干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com