
【题目】亚硝酸钠是一种食品添加剂,具有防腐和抗氧化作用。某同学对亚硝酸钠进行了相关探究。
(一)查阅资料
①亚硝酸钠(NaNO2)为无色、无味的晶体。
②HNO2是一种弱酸,酸性比醋酸略强,性质不稳定,易分解生成NO和NO2;能被常见强氧化剂氧化;但在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。
③AgNO2是一种微溶于水、易溶于酸的浅黄色固体。
(二)问题讨论
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是__________________________________________。
若发生中毒时,你认为下列物质有助于解毒的是______(填字母)。
a.鸡蛋清 b.胃舒平 [主要成分是Al(OH)3] c.小苏打 d.维生素C
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl两种固体,你需用的试剂是_____________________________。
(三)实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:①称取样品a g,加水溶解,配制成100 mL溶液。②取25.00 mL溶液于锥形瓶中,用0.0200mol·L-1 KMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液 V mL。
(3)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有________________。
(4)在进行滴定操作时,KMnO4溶液盛装在________(填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,____________________________________________________时达到滴定终点。
(5)滴定过程中发生反应的离子方程式是_________________________________;测得该样品中NaNO2的质量分数为________。
(6)若滴定过程中刚出现颜色变化就停止滴定,则测定结果________。(填“偏大”“偏小”或“无影响”)。
【答案】血红蛋白中Fe2+被NO![]() 氧化为Fe3+,导致血红蛋白失去运氧功能 d HNO3酸化的AgNO3溶液(或酚酞溶液或KI淀粉溶液和稀硫酸。其他合理试剂均可) 烧杯、100 mL容量瓶 酸式 锥形瓶中无色溶液变成浅紫(粉红)色,且30 s内不褪色 5NO
氧化为Fe3+,导致血红蛋白失去运氧功能 d HNO3酸化的AgNO3溶液(或酚酞溶液或KI淀粉溶液和稀硫酸。其他合理试剂均可) 烧杯、100 mL容量瓶 酸式 锥形瓶中无色溶液变成浅紫(粉红)色,且30 s内不褪色 5NO![]() +2MnO
+2MnO![]() +6H+=5NO
+6H+=5NO![]() +2Mn2++3H2O
+2Mn2++3H2O ![]() 偏小
偏小
【解析】
(1)血红蛋白中Fe2+起运载氧气的作用,一旦被氧化为Fe3+,将失去运载氧气的能力,使人体表现缺氧症状。答案为:血红蛋白中Fe2+被NO![]() 氧化为Fe3+,导致血红蛋白失去运氧功能;若发生中毒,需加入还原剂维生素C进行解毒,答案为d;
氧化为Fe3+,导致血红蛋白失去运氧功能;若发生中毒,需加入还原剂维生素C进行解毒,答案为d;
(2)寻找区分NaNO2和NaCl两种固体试剂时,若着眼点放在NaCl上,可使用硝酸酸化的硝酸银溶液;若着眼点放在NaNO2上,可采用检验水溶液的酸碱性或酸性条件下的氧化性的方法,答案为:HNO3酸化的AgNO3溶液(或酚酞溶液或KI淀粉溶液和稀硫酸。其他合理试剂均可);
(3)上述实验①是配制一定物质的量浓度的溶液,所需玻璃仪器除玻璃棒、胶头滴管之外还有烧杯、100 mL容量瓶。答案为烧杯、100 mL容量瓶;
(4)在进行滴定操作时,因KMnO4溶液具有强氧化性,会腐蚀橡皮管,所以应盛装在酸式滴定管内;当滴入最后一滴溶液,锥形瓶中无色溶液变成浅紫(粉红)色,且30 s内不褪色,达滴定终点,答案为:酸式;锥形瓶中无色溶液变成浅紫(粉红)色,且30 s内不褪色。
(5)滴定过程中发生反应的离子方程式是5NO![]() +2MnO
+2MnO![]() +6H+=5NO
+6H+=5NO![]() +2Mn2++3H2O;
+2Mn2++3H2O;
NaNO2与KMnO4发生反应的关系式为
5NaNO2 —— 2KMnO4
5mol 2mol
0.01×10-3V×4×5 0.02×10-3V×4
该样品中NaNO2的质量分数为![]() ,答案为5NO
,答案为5NO![]() +2MnO
+2MnO![]() +6H+=5NO
+6H+=5NO![]() +2Mn2++3H2O;
+2Mn2++3H2O;![]() ;
;
(6)若滴定过程中刚出现颜色变化就停止滴定,则KMnO4的用量偏少,测定结果偏低,答案为偏低。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期元素,且原子序数依次增大。A是元素周期表中半径最小的元素,B的基态原子2p轨道上未成对电子数是C的3倍;D的基态原子含13种运动状态不同的电子;E与A位于同一主族;F2+的3d轨道中有9个电子。(答题时用字母对应的元素符号表示)
⑴元素A、B、C的电负性由大到小的顺序为______。
⑵F的基态原子价层电子排布式为______。
⑶BC3的空间构型为______,与BC3互为等电子体的一种阴离子的化学式为______。
⑷一种化合物X的晶体结构如图,X的化学式为______。 (图中○:E+,●:DC![]() )
)
⑸化合物AC与EC中熔点更高的是_________,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在月球表面的土壤里发现了一种非常珍贵的资源—![]() He,它是可控核聚变的原料,关于:
He,它是可控核聚变的原料,关于:![]() He的叙述正确的是( )
He的叙述正确的是( )
A.![]() He核内中子数比质子数多l
He核内中子数比质子数多l
B.![]() He和
He和![]() He互为同位素
He互为同位素
C.He元素的相对原子质量就是3
D.![]() He和
He和![]() He属于同种元素,所以物理性质和化学性质都相同
He属于同种元素,所以物理性质和化学性质都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d的原子序数依次增大,X、Y、Z均是由这些元素组成的二元化合物,它们存在转化关系:M![]() X↑+Y↑+Z,组成化合物X的原子个数比为1:3,且液态X常用作制冷剂,Y的排放是形成酸雨的主要原因,且Y的组成元素位于同一主族且原子序数相差8,常温常压下Z为无色液体。下列说法错误的是( )
X↑+Y↑+Z,组成化合物X的原子个数比为1:3,且液态X常用作制冷剂,Y的排放是形成酸雨的主要原因,且Y的组成元素位于同一主族且原子序数相差8,常温常压下Z为无色液体。下列说法错误的是( )
A.原子半径:d>b>c>a
B.b的最低价氢化物能使湿润的蓝色石蕊试纸变红
C.M既能与强酸溶液反应,又能与强碱溶液反应
D.b2c5、dc3均为酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组设计“乙醇催化氧化实验”来探究催化剂的催化机理并对反应后的产物进行分析,装置(夹持装置等已省略)如图所示。试回答以下问题:
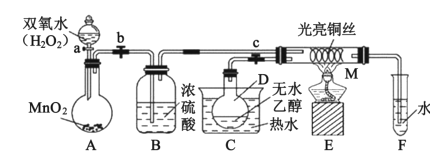
(1)C中热水的作用是___;在装入实验药品之前,应进行的操作是___。
(2)装入实验药品后,关闭活塞a、b、c,在铜丝的中间部分加热片刻,M处铜丝由红变黑,反应的化学方程式为___,然后打开活塞a、b、c,通过控制活塞a和b,间歇性地通入气体,即可在M处观察到受热部分的铜丝交替出现变红、变黑的现象。铜丝由黑变红时,发生反应的化学方程式为___。通过实验,可以得出结论:该实验过程中催化剂___(填“参加”或“不参加”)化学反应。
(3)反应进行一段时间后,试管F中能收集到的有机物主要有___、___。
(4)若试管F中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还有___。要除去该物质,可先在混合液中加入___(填字母),然后通过___即可(填操作名称)。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.是一种重要的有机合成中间体,由芳香烃A和E为有机原料和其他必要试剂制备Ⅰ的合成路线如图:

已知:Ⅰ.RX![]() RCOOH;
RCOOH;
Ⅱ.R—CH=CH2![]() R—CH2CH2Br;
R—CH2CH2Br;
Ⅲ.![]() 。
。
请回答下列问题:
(1)A的分子式为___。Ⅰ中含有官能团的名称为_____。
(2)C→D、H→I的反应类型分别为____、____。
(3)E的化学名称为______,一定条件下,E发生加聚反应的化学方程式为____。
(4)F→G的化学方程式为____。
(5)H的结构简式为____。
(6)同时满足下列条件的C的同分异构体有__种(不考虑立体异构);其中核磁共振氢谱有5组峰的结构简式为____。
①能与FeCl3溶液发生显色反应
②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往FeBr2溶液中通入Cl2时,随参加反应Cl2物质的量的变化,溶液中某些离子的浓度变化情况如图所示。下列说法不正确的是

A.当n(Cl2)<M mol时,发生的离子反应:2Fe2++Cl2=2Fe3++2Cl―
B.当n(Cl2)=M mol时,离子浓度关系:c(Fe3+)︰c(Br-)︰c(Cl-)=1︰2︰2
C.当n(Cl2)=2M mol时,离子浓度大小关系:c(Cl-)>c(Br-)
D.当Br―开始被氧化时,通入Cl2的物质的量小于原FeBr2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
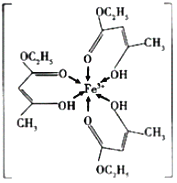
①此配合物中,铁离子价电子排布图为_______________;
②此配离子中碳原子的杂化轨道类型为_________________;
③此配离子中含有的化学键为_______________。
A 离子键 B 金属键 C 极性键 D 非极性键 E 配位键 F 氢键 G σ键 H π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_________。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。
(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒____(请写一个分子和一个离子)。
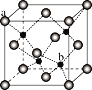
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则晶包的棱长为_____nm(NA表示阿伏伽德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知五种元素的原子序数的大小顺序为 C>A>B>D>E,A、C同周期,B、C 同主族;A与B形成离子化合物,![]() 中所有的离子的电子数相同, 其电子总数为 30;D 和 E 可形成 5核10电子的分子。试回答下列问题:
中所有的离子的电子数相同, 其电子总数为 30;D 和 E 可形成 5核10电子的分子。试回答下列问题:
(1)写出下列物质的电子式:
![]() 的电子式:____________________;A、B、E形成的化合物:____________________;
的电子式:____________________;A、B、E形成的化合物:____________________;
(2)A、B 两元素组成的化合物![]() 存在的化学键是__________________________________。
存在的化学键是__________________________________。
(3)写出 D 和 E 形成的 5 核 10 电子分子与氯气的第一步反应的方程式:___________________________________________________。
Ⅱ.对下列物质进行分类(均填序号)。互为同素异形体的是________________;互为同分异构体的是________________;互为同系物的是________________.
①![]() 和
和![]() ;②
;②![]() 与
与![]() ;③
;③![]() 和
和![]() ;④金刚石与水晶; ⑤正戊烷和异戊烷 ⑥
;④金刚石与水晶; ⑤正戊烷和异戊烷 ⑥![]() 和
和 ![]() ⑦
⑦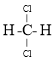
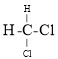 ;⑧
;⑧![]() 与
与![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com