
【题目】短周期主族元素a、b、c、d的原子序数依次增大,X、Y、Z均是由这些元素组成的二元化合物,它们存在转化关系:M![]() X↑+Y↑+Z,组成化合物X的原子个数比为1:3,且液态X常用作制冷剂,Y的排放是形成酸雨的主要原因,且Y的组成元素位于同一主族且原子序数相差8,常温常压下Z为无色液体。下列说法错误的是( )
X↑+Y↑+Z,组成化合物X的原子个数比为1:3,且液态X常用作制冷剂,Y的排放是形成酸雨的主要原因,且Y的组成元素位于同一主族且原子序数相差8,常温常压下Z为无色液体。下列说法错误的是( )
A.原子半径:d>b>c>a
B.b的最低价氢化物能使湿润的蓝色石蕊试纸变红
C.M既能与强酸溶液反应,又能与强碱溶液反应
D.b2c5、dc3均为酸性氧化物
【答案】B
【解析】
化合物X的原子个数比为1:3,且液态X常用作制冷剂,则X为氨气;Y的排放是形成酸雨的主要原因,且Y的组成元素位于同一主族且原子序数相差8,则Y为二氧化硫;常温常压下Z为无色液体,则Z为水;M为亚硫酸氢铵;短周期主族元素a、b、c、d的原子序数依次增大,X、Y、Z均是由这些元素组成的二元化合物,则a、b、c、d分别为氢元素、氮元素、氧元素、硫元素。
A.同周期原子半径从左到右逐渐减小,同主族元素从上到下原子半径逐渐增大,硫位于第三周期,在四种元素中原子半径最大,氢位于第一周期,原子半径最小,则原子半径:S>N>O>H,故A正确;
B.b的最低价氢化物为氨气,氨气为碱性气体,能使湿润的红色石蕊试纸变成蓝色,故B错误;
C.M为亚硫酸氢铵,为弱酸弱碱盐,则既能与强酸溶液反应,又能与强碱溶液反应,故C正确;
D.N2O5、SO3均能与碱发生反应只生成盐和水,则均为酸性氧化物,故D正确;
综上所述,答案为B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】40℃,向体积为VL的密闭容器中充入NO,容器内各组分的物质的量随时间变化曲线如图所示。下列说法正确的是

A.X是N2O
B.1 min~3 min时,v(NO2)=1/6Vmol·(L·min)-1
C.40℃时该反应的平衡常数为1
D.NO2和X的浓度相等可以作为判断反应到达平衡的标志
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(注意溴原子的连接位置,下同),1 mol某芳香烃A充分燃烧后可以得到9 mol CO2和5 mol H2O,该烃苯环上的一氯代物有2种。该烃A在不同条件下能发生如下所示的一系列变化。

请回答下列问题
(1)写出A的结构简式:__________,A中官能团的名称是________。
(2)上述反应中,②是________反应,⑦是________反应。(填反应类型)
(3)写出D、E物质的结构简式:D_______,E_______。
(4)写出A→C反应的化学方程式:____________________。
(5)写出F→H反应的化学方程式:________________。
(6)写出F催化氧化反应的化学方程式:___________。
(7)下列关于F的说法不正确的是______(填序号)。
a. 能发生消去反应 b. 能与金属钠反应
c. 1mol F最多能和4mol氢气反应 d. 分子式C9H11O
e. 能使酸性高锰酸钾褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若甲烷与氯气以物质的量之比1:3混合于试管中进行如下实验(如图),下列对于试管内发生的反应及现象的说法正确的是( )
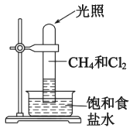
A.反应完全后,向饱和食盐水中加入紫色石蕊试液无变化
B.甲烷和Cl2反应后的产物只有CHCl3和HCl两种产物
C.反应过程中试管内黄绿色逐渐消失,试管壁上有油珠产生
D.CH4和Cl2完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有7种元素的性质如下表所示,它们位于第二或第三周期,下列判断错误的是( )

A.编号为⑥的元素比编号为②的元素金属性强,所以⑥的单质能从②形成的盐溶液中置换出②的单质
B.编号为④⑤的原子之间可形成共价化合物
C.编号为⑦的元素的最低价氢化物与最高价氧化物对应的水化物能反应生成盐
D.编号为⑥的单质一般保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是(已知:lg 2=0.3,Ksp(ZnS)=3×10-25)
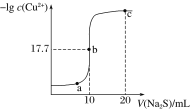
A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.该温度下Ksp(CuS)=4×10-36
D.向100 mL Zn2+、Cu2+浓度均为10-5mol·L-1的混合溶液中逐滴加入10-4 mol·L-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种食品添加剂,具有防腐和抗氧化作用。某同学对亚硝酸钠进行了相关探究。
(一)查阅资料
①亚硝酸钠(NaNO2)为无色、无味的晶体。
②HNO2是一种弱酸,酸性比醋酸略强,性质不稳定,易分解生成NO和NO2;能被常见强氧化剂氧化;但在酸性溶液中它也是一种氧化剂,如能把I-氧化成I2。
③AgNO2是一种微溶于水、易溶于酸的浅黄色固体。
(二)问题讨论
(1)人体正常的血红蛋白中应含Fe2+,误食亚硝酸盐(如NaNO2)会致使机体组织缺氧,出现青紫而中毒,原因是__________________________________________。
若发生中毒时,你认为下列物质有助于解毒的是______(填字母)。
a.鸡蛋清 b.胃舒平 [主要成分是Al(OH)3] c.小苏打 d.维生素C
(2)由于亚硝酸钠和食盐性状相似,曾多次发生过将NaNO2误当食盐食用的事件。要区别NaNO2和NaCl两种固体,你需用的试剂是_____________________________。
(三)实验测定
为了测定某样品中NaNO2的含量,某同学进行如下实验:①称取样品a g,加水溶解,配制成100 mL溶液。②取25.00 mL溶液于锥形瓶中,用0.0200mol·L-1 KMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液 V mL。
(3)上述实验①所需玻璃仪器除玻璃棒、胶头滴管之外还有________________。
(4)在进行滴定操作时,KMnO4溶液盛装在________(填“酸式”或“碱式”)滴定管中。当滴入最后一滴溶液,____________________________________________________时达到滴定终点。
(5)滴定过程中发生反应的离子方程式是_________________________________;测得该样品中NaNO2的质量分数为________。
(6)若滴定过程中刚出现颜色变化就停止滴定,则测定结果________。(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘肃马家窑遗址出土的青铜刀是我国最早冶炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用以下反应实现了“铜―→铜绿―→……―→铜”的转化。
铜![]() 铜绿
铜绿![]() A
A![]() Cu(OH)2
Cu(OH)2![]() B
B![]() Cu
Cu
(1)从物质分类标准看,“铜绿”属于________(填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2)写出B的化学式:________________。
(3)请写出铜绿与盐酸反应的化学方程式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4 L CCl4中含CCl4分子数为NA
B. 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等
C. 0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D. 3.9 g Na2O2 晶体中含有的离子总数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com