
如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫。
在催化剂作用下,CO2和H2可以制取甲醇和乙醇。如:2CO2(g)+6H2(g)
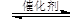 CH3CH2OH(g)+3H2O(g)
。
CH3CH2OH(g)+3H2O(g)
。
(Ⅰ) 在一定压强下,利用CO2反应制取乙醇,测得反应的实验数据如下表。分析表中数据回答下列问题:
|
|
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2.0 |
60 |
43 |
28 |
15 |
|
3.0 |
83 |
62 |
37 |
22 |
温度升高,平衡常数K值将 (填“增大”、“减小”、或“不变”)。提高氢碳比[n(H2)/n(CO2)], 平衡常数K值将 (填“增大”、“减小”、或“不变”)。
在600K时反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到800K D.使用合适的催化剂
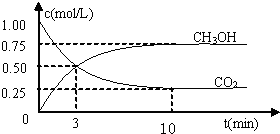
(Ⅱ)某温度下,在体积为l L的密闭容器中充入lmol CO2和4mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
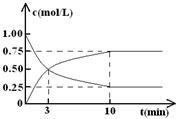
从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= ;
氢气的平衡浓度为 mol/L。
减小 , 不变 ; AB; 0.075 mol/(L.min); 1.75
【解析】
试题分析:(Ⅰ)根据表中数据可知,随着温度的升高,CO2的转化率减小,这说明升高温度平衡向逆反应方向移动,则正反应是放热反应,由此升高温度平衡常数减小。平衡常数只与温度有关系,由此提高氢碳比[n(H2)/n(CO2)], 平衡常数K值不变。根据方程式可知,正反应是体积减小的可逆反应,则缩小容器的体积,增大压强,平衡向正反应方向进行;通入CO2,增大反应物的浓度,平衡向正反应方向进行;升高温度,平衡向逆反应方向进行,催化剂不能改变平衡状态,所以答案选AB。
(Ⅱ)根据图像可知,反应进行到10min时物质的浓度不再发生变化,说明反应达到平衡状态。此时生成甲醇的浓度是0.75mol/L,则从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=0.75mol/L÷10min=0.075
mol/(L·min)。根据方程式CO2(g)+3H2(g)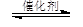 CH3OH(g)+H2O(g)可知,消耗氢气的浓度是0.75mol/L×3=2.25mol/L,则剩余氢气的浓度是4mol/L-2.25mol/L=1.75mol/L。
CH3OH(g)+H2O(g)可知,消耗氢气的浓度是0.75mol/L×3=2.25mol/L,则剩余氢气的浓度是4mol/L-2.25mol/L=1.75mol/L。
考点:考查化学平衡常数的判断、反应速率的计算以及外界条件对平衡状态的影响
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提升学生的学科素养。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
查看答案和解析>>
科目:高中化学 来源: 题型:
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 16 |
| 3 |
| 16 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2012?枣庄二模)碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(2012?枣庄二模)碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.| n(H2) | n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2011?天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.
(2011?天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH- Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动
Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动 Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动
Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动查看答案和解析>>
科目:高中化学 来源: 题型:

| c(CH3OH)×c(H2O) |
| c(CO2)×c3(H2) |
| c(CH3OH)×c(H2O) |
| c(CO2)×c3(H2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com