
����Ŀ������������(Mn3O4)�㷺Ӧ�����������Ų��ϡ��������Ʊ�����һ���Ե�Ʒλ�̿�(��MnCO3��Mn2O3��MnOOH������Fe2O3��Al2O3��SiO2)Ϊԭ������Mn3O4�Ĺ���������ͼ��
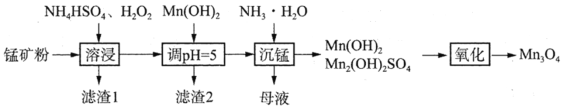
��֪��![]()
�ش��������⣺
(1) MnOOH��MnԪ�صĻ��ϼ�Ϊ________��
(2)���ܽ�����H2O2��������________��
(3)������2������Ҫ�ɷ���________��
(4)��ĸҺ�������ʵ���Ҫ�ɷ���________��ѭ�����ø����ʵķ�����________��
(5)��������ʱ�����������ˮ�У�70��ˮԡ���ȣ�ͨ����������������ȫ��ת��ΪMn3O4��Mn(OH)2����Mn3O4��Ӧ�Ļ�ѧ����ʽΪ________����Ӧ����Һ��![]() ________(����������������С������������)��
________(����������������������������)��
���𰸡�+3 ��+3��MnԪ�ػ�ԭ��Mn2+ Fe(OH)3��Al(OH)3 (NH4)2SO4 ���ȵ�213~308��ֽ����ɰ�����NH4HSO4���ֱ�ѭ�������̺��ܽ��л��H2SO4����NH4HSO4ѭ�����ܽ��� ![]() ��С
��С
��������
�̿��(��MnCO3��Mn2O3��MnOOH������Fe2O3��Al2O3��SiO2)����NH4HSO4��H2O2�ܽ���MnCO3��Mn2O3��MnOOHת��ΪMn2+��Fe2O3��Al2O3ת��ΪFe3+��Al3+��SiO2���ܶ�������1������Mn(OH)2����pH=5����ʱFe3+��Al3+ת��ΪFe(OH)3��Al(OH)3��������2�����백ˮ���̣���ʱ��ת��ΪMn(OH)2��Mn2(OH)2SO4��ͨ����������70��ˮԡ���ȣ����õ�Mn3O4��
(1)MnOOH��OԪ��Ϊ-2�ۣ�HԪ��Ϊ+1�ۣ������������ϼ۴�����Ϊ0���㣬Mn�Ļ��ϼ�Ϊ+3�ۣ�
(2)���ܽ����У���һ����Mn��+3�۽�Ϊ+2�ۣ�����H2O2�������ǽ�+3�۵�Mn��ԭΪMn2+��
(3)������������֪��������2������Ҫ�ɷ�ΪFe(OH)3��Al(OH)3��
(4)��������������ĸҺ������Ϊ(NH4)2SO4��ѭ�����ø����ʵķ����ǣ����ȵ�213~308��ֽ����ɰ�����NH4HSO4���ֱ�ѭ�������̺��ܽ��л��H2SO4����NH4HSO4ѭ�����ܽ��У�
(5)����ʱ��Mn(OH)2����70��ˮԡ���ȣ�ͨ��������������Mn3O4����Ӧ����ʽΪ![]() ��Mn(OH)2�ʼ��ԣ�Mn3O4������ˮ����Ӧ������Mn(OH)2��Ũ�Ƚ��ͣ����Է�Ӧ����ҺpH��С��
��Mn(OH)2�ʼ��ԣ�Mn3O4������ˮ����Ӧ������Mn(OH)2��Ũ�Ƚ��ͣ����Է�Ӧ����ҺpH��С��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A.CaCO3��ϡ���ᷴӦ��![]()
B.FeSO4��Һ����ˮ��Ӧ��![]()
C.NaOH��Һ�����H2C2O4��Һ��Ӧ��![]()
D.C6H5ONa��Һ��ͨ������CO2: ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������dzµ�������������Ϊ���ڴ������������������ζ��������������ʵ��������Ҳ��������ͼ��ʾ��װ����ȡ�����������ش��������⣺

��1��д����ȡ���������Ļ�ѧ��Ӧ����ʽ ��
��2��Ũ����������ǣ� ��
��3������̼������Һ����Ҫ������___ ��
��4��װ����ͨ�����ĵ���Ҫ���ڱ���̼������Һ��Һ���ϣ����ܲ�����Һ�У�Ŀ����________________��
��5����Ҫ���Ƶõ������������������Ӧ���õ�ʵ�������__________��
��6���������������ķ�Ӧ�ǿ��淴Ӧ����Ӧ�ﲻ����ȫ����������Ӧһ��ʱ��ʹﵽ�˸÷�Ӧ���ȣ�Ҳ���ﵽ��ѧƽ��״̬������������˵���Ҵ��������������Ӧ�Ѵﵽ��ѧƽ��״̬����(�����) ��
����λʱ�������1mol����������ͬʱ����1molˮ
����λʱ�������1mol����������ͬʱ����1mol����
����λʱ�������1mol�Ҵ���ͬʱ����1mol����
������Ӧ���������淴Ӧ���������
��������и����ʵ�Ũ�Ȳ��ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������У���HCl����N2����NH3����Na2O2����C2H4����NaOH����Ar
��1��ֻ���ڼ��Լ��ķ�����___��ֻ�ɷǼ��Լ����ɵķǼ��Է�����__��(����ţ���ͬ)��
��2��CO32��������ԭ�ӵ��ӻ����������__�����Ŀռ乹����__��
��3����K3[Fe��CN��6]������������__��������__�������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(Cl2)�Ǹ��л�ѧһ�ַdz���Ҫ�����嵥�ʣ������Ʊ��������Ʒ��ԭ�ϡ�
��.��ͬѧ��ʵ�����������Ϊ1:3�������Ϳ���(�����뷴Ӧ)�Ļ�������볱ʪ��̼���Ʒ�Ӧ���Ʊ�Cl2O����ʵ��װ����ͼ��ʾ��

��֪��Cl2O�۵�Ϊ-120.6�����е�Ϊ2.0�������³�ѹ��Ϊһ���ػ�ɫ���塣
(1)����B������Ϊ________��KMnO4��Ũ���ᷴӦ����Cl2�����ӷ���ʽΪ________��
(2)װ��C������Ϊ________��װ��E�е�������________��
(3)�����볱ʪ��̼������Cl2O�Ļ�ѧ����ʽΪ________��
��.��ͬѧ��ʵ������Cl2�����ڵ�S��Ӧ�Ʊ�S2Cl2����ʵ��װ����ͼ��ʾ��

��֪��S2Cl2�۵�Ϊ-76�����е�Ϊ138����������Ϊ�Ȼ�ɫ��Һ�壬��ˮ��ˮ�⡣
(4)W��ʢ�ŵ��Լ�Ϊ________��
(5)��ͬѧӦ���к����IJ���˳��Ϊ________(�����)��
a.��ȼ�ƾ��� b.ֹͣͨ���� c.��ʼͨ���� d.Ϩ��ƾ���
(6)����S2Cl2��ˮ��Ӧ�IJ���������ΪSO2��ʵ�����Ϊ________��
(7)��ʵ����Ľ��ĵط�Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2020���¹ڷ���������ȫ���㱬��������״�����������ߺ������У�56������30���ӡ��ƾ�����������������������Ⱦ�����Ч�����������й�˵����ȷ����( )
A.84����Һ����Ч�ɷ���![]()
B.84����Һ��ƾ����ʹ�ÿ���ǿ����Ч��
C.������ɱ����������Ϊ���������ȷ�������
D.�۱�ϩ��֬�������IJ����ֵij�ʼԭ��֮һ���۱�ϩ����ʹ���Ը��������Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µ��ݻ�������ܱ������У������������ǿ��淴ӦA(g)+3B(g)![]() 2C(g)+2D(s)�ﵽƽ��ı�־����
2C(g)+2D(s)�ﵽƽ��ı�־����
�� C������������C������������� �ڵ�λʱ��������amolA,ͬʱ����3amolB
�� A��B��C��Ũ�Ȳ��ٸı� �ܻ��������ܶȲ��ٸı�
�� ����������ѹǿ���ٸı� �������������ʵ������ٸı�
�� A��B��C��DŨ��֮��Ϊ1��3��2��2
A. �ڢ� B. �ڢݢ� C. �٢ۢܢ� D. �ڢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֻ��������£�
�ף�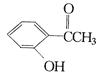 �ң�
�ң�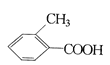 ����
����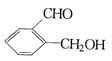
��ֱ�д������ס��ҡ������ֻ�����ķ�����ָ����ѡ�Լ�����Ҫ������ķ�����__________�����ҵķ�����_____________ ��������ķ���_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�������Ӿ������ЧӦ�����⣬��ѧ�������о���������ͼ��ʾ�Ķ�����̼��ѭ����ϵ��
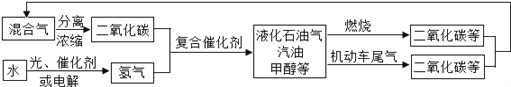
������ϵͼ�ܷ�ӳ�Ļ�ѧ�۵��ѧ˼���У�( )
�ٻ�ѧ�仯��Ԫ�������Dz���ģ���ȼ��ʱ��ѧ�ܿ���ת��Ϊ���ܺ��ܣ�
�۹��ܻ���ܿ���ת��Ϊ��ѧ�ܣ���������л�������ת����
�ݶ�����̼�ɳ�Ϊһ����Ҫ����Դ��
A. �٢ڢۢ� B. �٢ڢۢ� C. �٢ڢܢ� D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com