
【题目】锌的化合物在工农业生产中有广泛的应用。请回答下列问题:
(1)基态锌原子中,核外电子占据的最高能级的符号是_________。锌的熔点比铝的熔点低,原因是______________。
(2)锌冶炼过程中会产生污染性气体二氧化硫,已知液态二氧化硫可以发生类似于水的自身电离2SO2(l)![]() SO2++
SO2++![]() ,S和O两种元素中电负性较强的是_______,与SO2+互为等电子体的单质分子为_______(填化学式),SO2+中的σ键和π键数目比为______________。
,S和O两种元素中电负性较强的是_______,与SO2+互为等电子体的单质分子为_______(填化学式),SO2+中的σ键和π键数目比为______________。
(3) [Zn(CN)4]2在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2+4H++4H2O![]() [Zn(H2O)4]2++4HOCH2CN,HOCH2CN分子中碳原子轨道的杂化类型是_________,HCHO的立体构型为_______________,[Zn(CN)4]2中Zn2+与CN中的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2的结构可用示意图表示为__________________。
[Zn(H2O)4]2++4HOCH2CN,HOCH2CN分子中碳原子轨道的杂化类型是_________,HCHO的立体构型为_______________,[Zn(CN)4]2中Zn2+与CN中的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2的结构可用示意图表示为__________________。
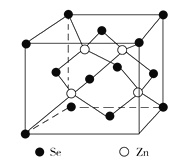
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为_________。若该晶胞密度为ρ g·cm3,硒化锌的摩尔质量为M g/mol,NA代表阿伏加德罗常数,则晶胞参数a为__________cm。
【答案】4s 铝原子半径比锌原子半径小,价电子比锌原子多,金属键较强 O N2 1∶2 sp3、sp 平面三角形 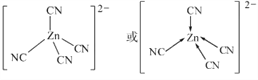 4
4 
【解析】
(1)基态锌原子中最高能级为4s,电子在吸收能量时会发生跃迁,变成激发态。锌的熔点比铝的熔点低,可从金属键的强弱判断。
(2)SO2+含有2个原子和10个价电子,因此与其互为等电子体的单质分子为氮气,因此SO2+的结构与氮气相似,σ键和π键数目比为1∶2。
(3)HOCH2CN的结构简式为 ,其中与羟基(—OH)相连的一个碳为饱和碳原子,价层电子对=4+0=4,杂化轨道类型为sp3,另外一碳原子与氮原子形成碳氮三键,三键含有1个σ键和2个π键,所以碳原子杂化轨道类型为sp;HCHO中碳原子杂化方式为sp2,立体构型是平面三角形。[Zn(CN)4]2中锌离子提供空轨道,C原子提供电子对形成配位键,结构示意图表示为:
,其中与羟基(—OH)相连的一个碳为饱和碳原子,价层电子对=4+0=4,杂化轨道类型为sp3,另外一碳原子与氮原子形成碳氮三键,三键含有1个σ键和2个π键,所以碳原子杂化轨道类型为sp;HCHO中碳原子杂化方式为sp2,立体构型是平面三角形。[Zn(CN)4]2中锌离子提供空轨道,C原子提供电子对形成配位键,结构示意图表示为: 。
。
(4)该晶胞中含有硒原子数为8×![]() +6×
+6×![]() =4,含有锌原子数为4,可得其化学式ZnSe。根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,而硒化锌的化学式为ZnSe,锌原子与硒原子个数相同,因此每个硒原子周围也有4个锌原子,所以硒原子的配位数为4。根据ρ=
=4,含有锌原子数为4,可得其化学式ZnSe。根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,而硒化锌的化学式为ZnSe,锌原子与硒原子个数相同,因此每个硒原子周围也有4个锌原子,所以硒原子的配位数为4。根据ρ=![]() =
=![]() ,所以V=
,所以V=![]() =a3,则a=
=a3,则a=  cm。
cm。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】含绒量是决定羽绒服质量优劣最重要的指标,按照我国实施的羽绒服新国标,羽绒服的含绒量要在50%以上,一些不法厂家填充“飞丝”或“人造羊毛来假冒羽绒,严重损害消费者的利益。“飞丝”由鸭毛、鹅毛甚至鸡毛经粉碎而成,人造羊毛的主要成分是聚丙烯腈纤维。请回答下列问题:
Ⅰ.鸭绒、蚕丝、人造羊毛都是高分子化合物,下列说法正确的是________(填序号)。
A.通过灼烧的方法可鉴别羽绒服中填充的是鸭绒还是飞丝
B.将人造羊毛和棉花进行混纺可提高纤维的性能
C.鸭绒、蚕丝、人造羊毛都有固定的熔沸点
D.鸭绒、蚕丝、人造羊毛燃烧过程中不会产生有毒气体
Ⅱ.合成聚丙烯腈纤维的方法很多,如以乙炔为原料,其合成过程如下:
CH≡CH+HCN![]() CH2=CHCN
CH2=CHCN![]() 聚丙烯腈
聚丙烯腈
(1)反应①的反应类型为__________。
(2)写出反应②的化学方程式:__________________,其反应类型为_________。
(3)CH2=CHCN在一定条件下可与苯乙烯(![]() )反应得到一种优良的塑料,该塑料的结构简式为__________。
)反应得到一种优良的塑料,该塑料的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在CH3COOH分子中的所有碳原子和氧原子都在同一平面
B.在 中单体为
中单体为![]() 和NC-CHO
和NC-CHO
C.1mol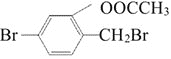 与NaOH溶液完全反应,消耗NaOH5mol
与NaOH溶液完全反应,消耗NaOH5mol
D.![]() 与Br21︰1加成可有4种加成产物
与Br21︰1加成可有4种加成产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知表中是某些有机物的模型图,根据要求回答下列问题:
有机物 | 甲 | 乙 | 丙 |
模型 |
|
|
|
(1)甲的分子式是___________________,其一氯代物有___________________种。
(2)写出乙与![]() 的
的![]() 溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
(3)丙的摩尔质量为![]() ,则用苯制备该物质时的催化剂是___________________。
,则用苯制备该物质时的催化剂是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙烯分子里含有一个碳碳双键的事实是( )
A.乙烯分子里碳氢原子个数之比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯能使酸性KMnO4溶液褪色
D.乙烯易与溴水发生加成反应,且1mol乙烯完全加成消耗1mol溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿![]() 主要成分为
主要成分为![]() ,还有少量CuS、
,还有少量CuS、![]() 等杂质
等杂质![]() 为原料制备绿矾晶体
为原料制备绿矾晶体![]() 的工艺流程如下:
的工艺流程如下:
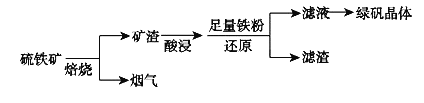
![]() “酸浸”过程,矿渣中的
“酸浸”过程,矿渣中的![]() 与稀
与稀![]() 反应的离子方程式___________________。
反应的离子方程式___________________。
![]() 烟气中的
烟气中的![]() 会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
![]() 滤液中金属阳离子的检验方法________________________________。
滤液中金属阳离子的检验方法________________________________。
![]() 溶液制备绿矾晶体过程中要保持
溶液制备绿矾晶体过程中要保持![]() 过量,理由___________________________。
过量,理由___________________________。![]() 结合化学用语说明原因
结合化学用语说明原因![]()
![]() 燃料细菌脱硫法是用氧化亚铁硫杆菌
燃料细菌脱硫法是用氧化亚铁硫杆菌![]() 对硫铁矿进行催化脱硫,同时得到
对硫铁矿进行催化脱硫,同时得到![]() 溶液。其过程如图所示:
溶液。其过程如图所示:
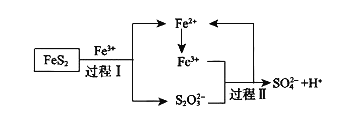
已知总反应为:![]()
![]() 将过程I离子方程式补充完整
将过程I离子方程式补充完整
____FeS2+_____Fe3++______ _______=7Fe2++________S2O32-+_____ _____
![]() 过程II反应的离子方程式___________________________________。
过程II反应的离子方程式___________________________________。
![]() 绿矾晶体在空气中易被氧化。取
绿矾晶体在空气中易被氧化。取![]() 样品,加水完全溶解,用酸化的
样品,加水完全溶解,用酸化的![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。反应原理:
。反应原理:![]() 。则绿矾晶体纯度的计算式为_______________。
。则绿矾晶体纯度的计算式为_______________。![]() 摩尔质量为
摩尔质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )

A.电源B极是正极
B.(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH2=CHCH3)的结构或性质不正确的是( )
A.能使溴水褪色
B.与HCl在一定条件下加成只得到一种产物
C.最多有7个原子在同一平面上
D.在空气中燃烧时火焰明亮并伴有黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com