
【题目】研究表明N2O与CO在Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的是

A. 总反应是放热反应
B. Fe+使反应的活化能降低
C. FeO+也是该反应的催化剂
D. Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热反应
【答案】C
【解析】
A.由图可知,反应物总能量大于生成物总能量;
B.Fe+作催化剂;
C. FeO+是反应过程的中间产物;
D.由图可知,Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步中均为反应物总能量大于生成物总能量。
A.由图可知,反应物总能量大于生成物总能量,为放热反应,A正确;
B.Fe+在反应前后的质量和性质保持不变,故其作催化剂,使反应的活化能减小,B正确;
C.催化剂是加入的物质,可以改变反应速率,但其质量和化学性质不变,而FeO+是反应过程的中间产物,因此不是催化剂,C错误;
D.由图可知,Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步中均为反应物总能量大于生成物总能量,因此二者均为放热反应,D正确;
故合理选项是C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。
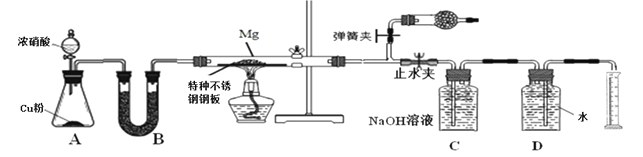
(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对于能源的利用大致可以分为三个时代:柴草能源、化石能源、多能源时代。正确的是( )
A.原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动
B.目前我国广大农村生活做饭使用的都是化石原料
C.多能源时代指的是新能源时代,包括核能、太阳能、氢能
D.化石燃料的燃烧没有污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的数値,下列说法正确的是( )
A. 常温常圧下,7.0g由丁烯与丙烯組成的混合气体中含有的氢原子数目为NA
B. 向1L的密闭容器中充入46gNO2气体,容器中气体的分子数为NA
C. 6.4g铜与足量的硫单质混合加热,转移电子的数目为0.2NA
D. 标准状况下,2.24LSO3中含有0.1NA个SO3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
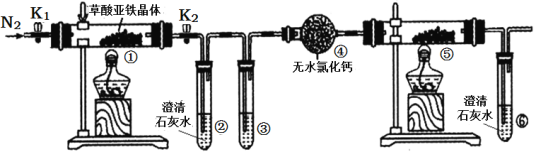
A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化既破坏离子键又破坏共价键的是( )
①碘的升华 ②液氨汽化 ③烧碱熔化 ④氯化钠溶于水 ⑤氯化氢溶于水 ⑥过氧化钠溶于水 ⑦氯化铵受热分解
A.③⑥B.④⑦C.①②⑤D.⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期五种元素A、B、C、D、E的原子序数依次增大。A、B、C的单质在常温下都呈气态,C原子最外层电子数是电子层数的3倍,C和E位于同主族。1molDAx与足量的A2C反应生成44.8L(标准状况)G气体。A、B的单质依次为G、T,在密闭容器中充入一定量的G、T,一定条件下发生反应G+T→W(未配平),测得各物质的浓度如表所示。
物质 | T | G | W |
10min时,c/(mol/L) | 0.5 | 0.8 | 0.2 |
20min时,c/(mol/L) | 0.3 | 0.2 | 0.6 |
回答下列问题:
(1)A、B、C能组成既含离子键又含共价键的化合物,该化合物的化学式为_________。
(2)B、C、D、E的简单离子中,离子半径由大到小排序为__________。(用离子符号表示)
(3)J、L是由A、B、C、E四种元素组成的两种常见酸式盐,J、L混合可产生有刺激性气味的气体,写出这两种溶液发生反应的离子方程式_______;J、L中能使酸性高锰酸钾溶液退色的是_______(填化学式)。
(4)B2A4-C2碱性燃料电池放电效率高。该电池放电时生成B2和A2C,正极反应式为_____;电池工作一段时间后,电解质溶液的pH_____(填“增大”“减小”或“不变”)。
(5)由A、B、C、D四种元素组成的单质、化合物在一定条件下的转化关系(部分条件和产物已省略)如图所示,已知M耐高温。
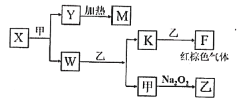
①X的电子式为______;W的结构式为________。
②已知W与乙反应生成K和甲是某重要化工生产步骤之一,提高其反应速率的方法除增大反应物浓度、增大压强外,还有______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物(主要为NO和NO2)污染是“蓝天计划”的重要内容之一。
(1)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为NO和NO2)污染, NO、O2和CH4的混合物反应体系主要发生如下反应:
2NO(g) + O2(g)![]() 2NO2(g) ΔH=-113.0 kJmol-1 ①
2NO2(g) ΔH=-113.0 kJmol-1 ①
CH4(g) + 2O2(g)![]() CO2(g) +2H2O (g) ΔH=-802. 3 kJmol-1 ②
CO2(g) +2H2O (g) ΔH=-802. 3 kJmol-1 ②
CH4(g) + 4NO(g)![]() 2N2(g) + CO2(g) + 2H2O (g) ΔH=-1160kJmol-1 ③
2N2(g) + CO2(g) + 2H2O (g) ΔH=-1160kJmol-1 ③
① 则反应CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O (g)的ΔH= ______。
N2(g)+CO2(g)+2H2O (g)的ΔH= ______。
② 反应CH4(g) + 2O2(g)![]() CO2(g) +2H2O (l) ΔH=-a kJmol-1,则a ____ 802. 3(填“>”、“<”或“=”)。
CO2(g) +2H2O (l) ΔH=-a kJmol-1,则a ____ 802. 3(填“>”、“<”或“=”)。
③ 在一定温度下,提高反应③中NO 转化率可采取的措施是 _____。
(2)利用电化学装置可消除氮氧化物污染,变废为宝。

① 图Ⅰ装置实现的能量转化形式是_____。石墨Ⅱ电极上发生的电极反应方程式为_____。相同条件下,放电过程中消耗的NO2和O2的体积比为_____。
② 图Ⅱ为电解NO制备NH4NO3的装置。该装置中阳极的电极反应式为_____。“反应室”中发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN中氮的化合价为+3
D. AlN的摩尔质量为41 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com